1 青岛大学 基础医学院 山东 青岛 266021 中国; 2 海阳市人民医院 检验科 山东 海阳 265100 中国
摘要 目的:探究下丘脑外侧区(LHA)促食肽(ghrelin)对肥胖大鼠的摄食及胃肠道运动的影响。方法:观察LHA注射促食肽对大鼠摄食及胃肠转运的影响。结果:大鼠LHA微量注射促食肽后,肥胖(DIO)大鼠的正常饮食、高脂饮食及高糖饮食均高于正常大鼠,但预注射促食肽受体拮抗剂[D-Lys3]-GHRP-6 (DLS)能够阻断这种作用。LHA注射促食肽,DIO大鼠的胃肠道转运速率明显加快,而预注射促食肽受体拮抗剂[D-Lys3]-GHRP-6 (DLS)显著阻断促食肽的促胃肠道转运作用。结论:下丘脑外侧区促食肽参与调节正常大鼠及DIO大鼠的摄食及胃肠道运动。
关键词:促食肽;下丘脑外侧区;摄食;胃运动
前言
促食肽(Ghrelin)一种唯一作用于摄食中枢的新型脑肠肽,含有28个氨基酸,主要由胃底粘膜分泌,又名生长素。先前研究发现,其特异性受体为生长激素促分泌素受体1a(GHSR1a)[1,2],因此无论是中枢还是外周注射促食肽,都能显著增加生长激素(GH)的释放,提示促食肽具有促进GH释放的作用[3]。已有研究证明促食肽与多种生理过程有关,包括调节睡眠/觉醒状态,能量平衡,能量稳态,奖励寻求和药物成瘾。促食肽能够调节食欲,能量消耗和新陈代谢[4]。脑室内注射促食肽能够显著增加大鼠的食物摄入量。因此,促食肽被认为是促进食欲的信号,以控制健康个体的食欲及能量平衡。促食肽特异性受体能够结合酰化的促食肽,诱导垂体前叶释放生长激素。
虽然促食肽大部分是由胃中内分泌细胞产生,但是肠、胰腺、肾脏、卵巢或脑等其他组织也可合成分泌少量的促食肽,有少部分在下丘脑弓状核(ARC)内合成。酰基化的促食肽推动胃分泌和胃运动。一方面,促食肽刺激胃肠道及胃肠消化器官分泌胃酸和消化酶。另一方面,促食肽能够缩短摄入的营养物质在胃肠内的停留时间,加速胃排空,刺激小肠和结肠的运动。这些动力学和预分泌效应联合饮食行为的调节有助于食物的消化和吸收。然而,促食肽通过缩短流经肠道时间限制了肠道反馈,从而决定摄食停止时间[3]。促食肽除了通过下丘脑回路表现出刺激食欲经典效应外,可能还参与饮食行为的调节。本研究从大鼠LHA中微量注射促食肽,采用生理学方法观察其对正常大鼠及肥胖大鼠摄食选择及胃肠道转运速率的影响,结果报道如下。
1 材料与方法
1.1实验动物
成年雄性SD大鼠,体质量在180-220 g,购于青岛市药物检验所,均在室温(25±1℃)、昼夜循环光照为12 h:12 h,自由饮水进食。实验开始前,大鼠禁食24 h,但可自由饮水。所有动物遵循《青岛大学实验动物保护和和使用管理方法》。所有实验都按照青岛实验动物中心标准。
1.2 DIO大鼠模型的建立
大鼠适应性饲养7天后,大鼠给予高脂饮食,喂养7周后,喂食高脂饮食的大鼠表现出对饮食的不同敏感性,体重最高的1/3大鼠被定义为饮食诱导肥胖( DIO)大鼠。其余大鼠给予正常动物饲料喂养7周,造模期间所有大鼠均自由饮水。
1.3脑置管术
实验前大鼠禁食一夜,大鼠腹腔注射戊巴比妥钠(100 mg/kg),麻醉后固定于脑立体定位仪,以前囟为零点,定位下丘脑外侧区LHA,植入一带有内芯的不锈钢套管,套管用自凝牙托粉固定于大鼠颅骨。
1.4 LHA微量注射促食肽对大鼠摄食的影响
将正常大鼠和DIO大鼠各分为4组,每组5只:(1)vehicle组;(2)促食肽组;(3)受体拮抗剂([D-Lys3]-GHRP-6 (DLS))组;(4)[D-Lys3]-GHRP-6 (DLS)+促食肽组。将大鼠转移至综合实验室动物监测系统笼中以适应环境,并在第一次研究之前监测饲养和代谢参数4天。CLAMS系统中的单个笼子可用于测定食物摄入量。注射药物或生理盐水后立即给予大鼠定量食物,连续监测4小时。
1.7 LHA微量注射促食肽对大鼠胃肠道转运的影响
为了观察大鼠LHA注射促食肽对胃肠道转运速率(GITT)的影响,我们通过观察标记粪便颗粒排出的时间进行监测。将大鼠转移到单独的笼子中,通过管饲法施用0.3 ml 6%的不可吸收染料(胭脂红,溶于0.5%甲基纤维素)。笼底用白纸覆盖,便于检测粪便中的胭脂红。强行管饲后,开始记录时间,大鼠随意饮食,直至第一个红色粪便排出,记录时间。
1.7统计学分析
应用SPSS 18.0和PPMS 1.5软件分析数据,所有数据均以(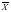 ±SD)表示,多样本均数比较采用单因素方差分析,两组间样本均数比较采用t检验,P < 0.05为差异有统计学意义。
±SD)表示,多样本均数比较采用单因素方差分析,两组间样本均数比较采用t检验,P < 0.05为差异有统计学意义。
2 结果
2.1 促食肽对大鼠摄食选择性的影响
在正常大鼠组或DIO大鼠组的组内比较结果显示,与NS组相比,LHA微量注射促食肽,各组大鼠的正常饮食(P<0.05)、高脂饮食(P<0.05)及高糖饮食(P<0.05)量均显著升高,且高脂或高糖饮食的摄食量升高更为显著(P<0.05),但对高脂饮食和高糖饮食的摄食量间无显著差异(P>0.05);LHA微量注射促食肽受体拮抗剂[D-Lys3]-GHRP-6,各组大鼠的正常饮食(P<0.05)、高脂饮食(P<0.05)及高糖饮食(P<0.05)量均显著降低,LHA注射[D-Lys3]-GHRP-6,可完全阻断促食肽促大鼠摄食作用(P<0.05,见表1)。
在正常大鼠组及DIO大鼠组的组间比较结果显示,与正常大鼠比较,DIO(P<0.05)大鼠更偏好高脂或高糖这些可口食物;LHA微量注射促食肽,DIO大鼠的正常饮食(P<0.05)、高脂饮食(P<0.05)及高糖饮食量变化率(P<0.05)均显著高于正常大鼠组。提示,DIO大鼠更偏好高脂或高糖这些可口食物;促食肽对这两组大鼠的促摄食作用不尽相同,即促食肽促摄食效应在DIO大鼠更为显著(P<0.05,见表1)。
表1 促食肽对大鼠摄食选择的的影响
| Groups | Food intake | ||||||
| Normal rat | DIO rat | ||||||
| Normal food | High fat food | High sweet food | Normal food | High fat food | High sweet food | ||
| NS | 10.34±0.85 | 12.23±1.26 | 11.84±2.13 | 13.56±0.97 | 15.56±3.07^ | 15.17±2.85^ | |
| 促食肽 | 12.55±2.16* | 15.45±3.25* | 14.95±3.54* | 17.65±2.27* | 21.65±3.85* | 20.65±3.42* | |
| [D-Lys3]-GHRP-6 | 7.86±0.74* | 9.86±1.09* | 8.86±1.06* | 8.13±2.51* | 12.59±1.29* | 11.59±2.69* | |
| [D-Lys3]-GHRP-6 +促食肽 | 10.04±1.01# | 13.14±2.49# | 11.24±1.89# | 14.91±1.23# | 16.91±2.57# | 16.21±3.04# | |
*P<0.05,与NS组相比;#P<0.05,与促食肽组相比;^P<0.05,与相同饮食的正常大鼠NS组相比
2.2 LHA微量注射促食肽对大鼠胃肠道转运速率的影响
为了探究大鼠摄食诱导的肥胖是否与大鼠胃肠道转运速率相关,因此通过测定大鼠有色粪便颗粒排出时间,比较大鼠胃肠道转运速率。结果显示,在正常大鼠组和DIO大鼠组的组内比较结果显示,与NS组相比,LHA注射促食肽,正常大鼠(P<0.05)和DIO大鼠(P<0.05)的胃肠转运速率均明显加快;与NS组相比,LHA注射[D-Lys3]-GHRP-6,这两组大鼠的胃肠转运速率均显著减慢(P<0.05)。这表明大鼠摄食诱导的肥胖可能与胃转运速率相关(见表2)。
在正常大鼠组及DIO大鼠组的组间比较结果显示,与正常NS组大鼠相比,DIO NS组大鼠胃肠转运速率明显减慢(P<0.05),;向正常大鼠及DIO大鼠LHA注射促食肽,正常组大鼠胃肠转运时间由152.29±16.55 min缩短至128.36±21.47 min,平均转运速率增加15.71 %,DIO组大鼠转运时间由197.58±30.17 min缩短至159.56±23.05 min,平均转运速率增加19.24 %。结果提示,内、外源性促食肽均可通过增加胃肠转运速率参与抑制肥胖形成过程(见表2)。
表2 LHA微量注射促食肽对大鼠胃肠转运速率的影响(min)
| Groups | Normal rat | DIO rat |
| NS | 152.29±16.55 | 197.58±30.17^ |
| 促食肽 | 128.36±21.47* | 159.56±23.05*^ |
| [D-Lys3]-GHRP-6 | 183.25±29.20* | 230.06±21.04* |
| [D-Lys3]-GHRP-6 +促食肽 | 149.17±11.08# | 183.67±14.37# |
*P < 0.05,与NS组相比;
#P<0.05,与促食肽组相比;^P < 0.05,与normal rat组相比
3 讨论
本实验主要目的是探究大鼠下丘脑LHA促食肽是否参与正常大鼠及DIO大鼠的摄食选择及胃肠道转运速率的调节。结果显示,大鼠LHA微量注射促食肽后,DIO大鼠的正常饮食、高脂饮食及高糖饮食均高于正常大鼠,且高脂饮食摄入量增高显著;预注射[D-Lys3]-GHRP-6 (DLS)显著阻断了这种作用;LHA微量注射促食肽,正常大鼠及DIO大鼠的胃转运速率明显加快,而预注射[D-Lys3]-GHRP-6 (DLS)显著阻断促食肽的促胃肠道转运作用。
先前研究表明促食肽参与多种生理过程,包括调节睡眠/觉醒状态、能量平衡、能量稳态、奖励寻求和药物成瘾[3,4]。本实验通过向正常大鼠及DIO大鼠下丘脑LHA直接注射促食肽或[D-Lys3]-GHRP-6 (DLS)(5 μg/μl),观察促食肽是否能够调节大鼠的正常饮食、高脂饮食及高糖饮食的摄入量,以及LHA中促食肽受体是否参与促食肽对大鼠代谢的调控,结果发现大鼠LHA微量注射促食肽后,与正常饮食组相比,高脂饮食及高糖饮食均高于正常饮食,且高脂饮食摄入量增高显著。而大鼠LHA微量注射[D-Lys3]-GHRP-6 (DLS)后,对大鼠的摄食改变与促食肽恰好相反;且预注射[D-Lys3]-GHRP-6 (DLS),促食肽对大鼠的促摄食作用明显减弱,表明LHA中的促食肽受体在促食肽调控摄食过程中发挥重要作用。
本实验为进一步探究促食肽对大鼠摄食调节的潜在机制,通过测定大鼠有色粪便颗粒排出时间,以探究大鼠摄食诱导的肥胖是否与大鼠胃肠道转运速率相关。结果显示与正常大鼠相比,LHA注射促食肽,正常大鼠及DIO大鼠的胃转运速率明显加快,且DIO大鼠胃转运速率增加更为明显;而预注射[D-Lys3]-GHRP-6 (DLS)阻断了促食肽的促大鼠的胃转运速率作用。这表明DIO大鼠摄食量高于正常大鼠有可能是因为DIO大鼠的胃转运速率高于正常大鼠,具体机制有待进一步探究。
总之,大鼠的摄食选择性及胃肠道运动的调控需由多个方面共同协调完成。同样,人类肥胖相关疾病与摄食行为也具有很大关系,因此,接下来的研究需要进一步的探究促食肽与其它神经元或相关肽的相互作用,以研讨治疗肥胖相关疾病的新的药理学策略。
参考文献
Janiuk I, Kaleczyc J, Kasacka I. Ghrelin-immunoreactive cells in the gastrointestinal tract of hypertensive rats[J]. Folia Histochem Cytobiol, 2016, 54(4): 181-185
Drott CJ, Franzén P, Carlsson PO. Ghrelin in rat pancreatic islets decreases islet blood flow[J]. Am J Physiol Endocrinol Metab. 2019, 7(8): 7-9
Aguinaga D, Medrano M, Cordomí A, et al. Cocaine Blocks Effects of Hunger Hormone, Ghrelin, Via Interaction with Neuronal Sigma-1 Receptors[J]. Mol Neurobiol, 2019, 56(2): 1196-1210
Xu HC, Pang YC, Chen JW, et al. Systematic Review and Meta-analysis of the Change in Ghrelin Levels After Roux-en-Y Gastric Bypass[J]. Obes Surg, 2019, 29(4): 1343-1351