湖北省恩施高中 湖北恩施 445500
有关中和滴定曲线的问题是高考的热点,也是高中化学的重点,是溶液中各种平衡的综合应用。
一、图像分析与变形
 1
1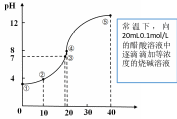 、滴定曲线中的关键点及其各种关系的分析
、滴定曲线中的关键点及其各种关系的分析

图1 图2
图1是两强溶液的混合,关键点主要是起点,起点主要计算PH和物质的量浓度,终点和中性点重合,图像趋势主要是终点附近的“突变”。
图2是一元强碱滴定一元弱酸,是分析的重点,各个关键点的分析和结论都具有一定的代表性,下表即是图2各个关键点的详解。
| 点 | 反应物的n之比 | 溶质 成分 | 溶液的酸碱性 | 微粒浓度 大小关系 | 微粒浓度 守恒式 | 溶液的本质特征、 判断的关键理由 |
| ①起点 | 只有HAc | HAc | 酸性 | c(HAc)>c(H+)> c(Ac—)>c(OH—) | c(HAc)+c(Ac—)= 0.1mol/L | 只有HAc的电离,弱电解质的电离都是微弱的 |
| ②半量点(即中和反应一半点) |
=2:1 | HAc NaAc | 酸性 | c(Ac—)>c(Na+)> c(HAc)>c(H+) >c(OH—) | c(Ac—)+c(OH—)= c(Na+)+c(H+) C(HAc)+c(Ac—)= 2c(Na+) | HAc和NaAc按物质的量之比1:1混合,HAc的电离强于Ac—的水解 |
| ③中性点 |
>1:1 | HAc NaAc | 中性 | c(Ac—)=c(Na+)> c(H+)=c(OH—) | c(Ac—)+c(OH—)= c(Na+)+c(H+) | HAc稍微过量一点或者NaOH稍微少加一点 |
| ④终点(即恰好反应点) |
=1:1 | NaAc | 碱性 | c(Na+)>c(Ac—)> c(OH—)>c(H+) | c(Ac—)+c(OH—)= c(Na+)+c(H+) c(HAc)+c(Ac—)= c(Na+) | NaAc溶液,只需要考虑Ac—的单水解 |
| ⑤过量一倍点 |
=1:2 | NaAc NaOH | 碱性 | c(Na+)>>c(OH—)> c(Ac—)>c(H+) | c(Ac—)+c(OH—)= c(Na+)+c(H+) c(Na+)= 2[c(HAc)+c(Ac—)] | NaAc和 NaOH按物质的量之比1:1混合,Ac—的水解被抑制 |
2、变形分析
更改溶液滴加顺序或者溶质的成分
①更改滴加顺序:图像变化趋势发生变化,分析的关键点没有改变,分析思路也没有变化。
②溶质为多元酸或者多元碱:由于酸的分步电离,导致中和反应的分步进行,所以分析出分步反应是关键。关键点也只需要分析四个:起点、恰好生成酸式盐的点、中性点(酸性极弱的也可能是第二个点就是中性点)、恰好生成正盐的点。
例1、某二元弱碱B(OH)2(K1=5.9×10-2、K2=6.4×10-5)。向10mL稀B(OH)2溶液中滴加等浓度盐酸溶液,B(OH)2、B(OH)+、B2+的浓度分数δ随溶液POH[POH=-lgc(OH)-]变化的关系如图3,以下说法正确的是
A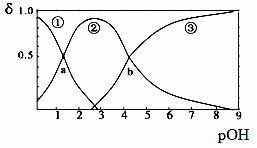 . 交点a处对应加入的盐酸溶液的体积为5mL
. 交点a处对应加入的盐酸溶液的体积为5mL
B. 当加入的盐酸溶液的体积为10mL时存在
c(Cl-)>c(B(OH)+)>c(H+)>c(OH-)>c(B2+)
C. 交点b处c(OH)=6.4×10-5
D. 当加入的盐酸溶液的体积为15mL时存在:
c(Cl-)+c(OH-)= c(B
2+)+c(B(OH)+)+ c(H+),
【分析】答案:C。图中曲线①B(OH)2,②为B(OH)+,
③为B2+;交点a处对应加入的盐酸溶液的体积为5mL 图3
时,反应生成等浓度的B(OH)Cl和B(OH)2混合液,由于两种溶质水解电离能力不同,所以B(OH)2、B(OH)+ 浓度分数δ不相等,A错误;当加入的盐酸溶液的体积为10mL时,溶液为B(OH)Cl,溶液显酸性,根据B(OH)2(K1=5.9×10-2、K2=6.4×10-5)可知,c(Cl-)>c(B(OH)+)>c(H+)> c(B2+)>c(OH-),B错误;交点b处时,c(B(OH)+)= c(B2+),根据B(OH)+![]() B2++ OH-,K2= c(OH-)=6.4×10-5, C正确;当加入的盐酸溶液的体积为15mL时,生成等体积等浓度B(OH)Cl和BCl2的混合液,存在电荷守恒为c(Cl-)+c(OH-)= 2c(B2+)+c(B(OH)+)+ c(H+),D错误。
B2++ OH-,K2= c(OH-)=6.4×10-5, C正确;当加入的盐酸溶液的体积为15mL时,生成等体积等浓度B(OH)Cl和BCl2的混合液,存在电荷守恒为c(Cl-)+c(OH-)= 2c(B2+)+c(B(OH)+)+ c(H+),D错误。
③溶质为混合物:分析化学反应仍然是关键,必须分出反应的先后。
例2:(2018年浙江省学考第23题)在常温下,向10mL浓度均为0.1mol·L-1的NaOH和Na2CO3混合溶液中滴0.1mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图4所示。下列说法正确的是
A.在a点的溶液中,c(Na+)>c(CO32-)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中,2n(CO32-)+n(HCO3-)<0.001mol
C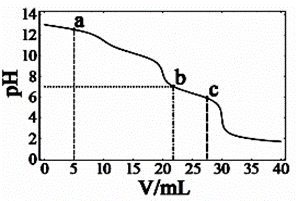 .在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
.在c点的溶液pH<7,是因为此时HCO3-的电离能力大于其水解能力
D.若将0.1mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:
c(Na+)=c(CH3COO-)
【分析】答案:B。随着盐酸的滴入,第一步:OH—+ H+ = H2O;第二步:
CO32—+ H+=HCO3—;第三步:HCO3—+ H+= H2CO3。
不管溶质怎么改变,分析清楚化学反应是关键,理清反应的先后关系。
关键点都是恰好反应完成或者溶质的物质的量成倍数关系的混合。
更改横坐标、纵坐标的意义或者图像的变化 图4
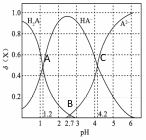 把坐标的意义改为PH的变化,随着PH的增加,其实就是向溶液中不断加入碱溶液,本质仍然是酸碱中和反应,分析思路与前面的基本一致。先要理清反应的先后,但更应该注意关键点,尤其是交点,往往是突破得关键点。 例3:(2017年全国理综II卷第12题)改变0.1mol/L二
把坐标的意义改为PH的变化,随着PH的增加,其实就是向溶液中不断加入碱溶液,本质仍然是酸碱中和反应,分析思路与前面的基本一致。先要理清反应的先后,但更应该注意关键点,尤其是交点,往往是突破得关键点。 例3:(2017年全国理综II卷第12题)改变0.1mol/L二
元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的
量![]() 分数 随pH的变化如图5所示已知
分数 随pH的变化如图5所示已知
![]()
[ ]。
下列叙述错误的是
A. lg[K2(H2A)]=-4.2
B. pH=4.2时,c(HA-) = c(A2-) = c(H+)
C. pH=2.7时,c(HA-) >c(H2A)= c(A2-)
D. pH=1.2时,c(H2A)=c(HA-) 图5
【分析】答案:D。该过程涉及的离子反应,第一步:H2A + OH— = HA- + H2O ,第二步:HA-+ OH— = A2- + H2O。由反应决定了H2A、HA-、A2-三种微粒的物质的量分数变化规律,分别由特殊点A、C、B可计算出H2A的第一步电离常数Ka1、第二步电离常数Ka2和Ka1·Ka2 ,从而确定各点的微粒浓度关系。
即使将横坐标和纵坐标进行交换,分析的思路也仍然一样。
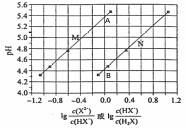 例4:(2017年全国理综I卷第13题)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图6所示。下列叙述错误的是
例4:(2017年全国理综I卷第13题)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图6所示。下列叙述错误的是
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>
c(X2-)>c(H+)=c(OH-)
【分析】答案:D。该过程涉及的离子反应依次为:H2X + OH— = HX- + H2O ,第二步:HX-+ OH— = X2- + H2O。从两个关键点可以算出两个电离常数分别为 图6
10-5.4和10-4.4,根据第一级电离常数大于第二级电离常数,可以得出B点所在直线N表示的是第一步电离,A点所在的直线M表示的是第二步电离。
分析清楚化学反应,理清各步反应的先后顺序,分析曲线的变化趋势,以各个关键点为突破口,是酸碱中和滴定曲线解题的关键。