1.新疆医科大学第六附属医院检验科 新疆维吾尔自治区乌鲁木齐市 830000
[摘要]:目的:探讨56℃水浴灭活处理含胍盐保存液的咽拭子样本对乌鲁木齐地区2019新型冠状病毒核酸检测结果的影响。方法:使用含胍盐保存液的样本管收集新疆乌鲁木齐地区2020年7-8月2019新型冠状病毒肺炎恢复期患者咽拭子样本170例。将170例样本等量提取双份并分组:试验组:56℃恒温水浴孵化30分钟处理后提取核酸;对照组:室温放置30分钟后提取核酸。对上述两组核酸提取物进行实时荧光定量聚合酶链反应(RT-PCR)检测,分别检测N、ORF1ab和人体上皮细胞(ribonucleoprotein,RNP)基因(试剂内标基因),用循环阈值(Ct)评价检验结果。阳性样本:检测样本在FAM和VIC通道Ct值≤40且有明显的扩增曲线;阴性样本:检测样本在FAM和VIC通道无扩增曲线或Ct值>40。结果:1.对照组阳性标本检出率显著高于经56℃水浴灭活处理的试验组,差异具有统计学意义(P<0.05);2.两组样本人体上皮细胞RNP基因均呈现明显典型的扩增信号;3.对照组结果分析:46例阳性标本中,单N基因阳性32例,N基因和ORF1ab基因同时阳性14例;未见VIC通道检测ORF1ab单基因阳性;4.试验组结果分析:单N基因阳性14例,N基因和ORF1ab基因同时阳性结果9例;经56℃水浴灭活处理的咽拭子标本,N基因由阳变阴的标本23例(占比50%),ORF1ab基因由阳变阴的标本6例(占比42.86%);受到干扰的样本Ct值均在36以上,即反应体系中起始模板量较低的样本(通常认为是弱阳性标本/灰区标本)。结论:新疆乌鲁木齐地区2020年7-8月含胍盐保存液的咽拭子样本经56℃水浴灭活处理30分钟后,2019新型冠状病毒核酸降解,FAM通道检测的N基因及VIC通道检测的ORF1ab基因Ct值升高,造成假阴性结果增多。
关键词:2019新型冠状病毒(2019-nCoV);咽拭子;病毒灭活;实时荧光定量聚合酶链反应(RT-PCR);
中图分类号:R373.1 文献标识码:A
中华医学会检验分会发布的《2019新型冠状病毒肺炎临床实验室生物安全防护专家共识》[1]及国家卫建委发布的《新型冠状病毒实验室生物安全指南(第二版)》[2]中均指出,2019-nCoV进行核酸扩增前必须先对标本进行灭活。目前已有研究表明以RT-PCR为主要检测手段的阳性率仅有30%-50%左右;除感染者病毒复制率低、咽拭子标本采样不合格原因外,张沁欣、段秀枝等人研究显示,核酸检测前56℃水浴灭活病毒的步骤极有可能显著降低可检出病毒核酸模板量,进而造成低浓度样本假阴性率升高[3-4];姜蕾等研究表明56℃灭活30分钟和胍盐RNA保存液两种灭活方式对2019新型冠状病毒核酸荧光定量PCR结果无影响[5]。目前乌鲁木齐地区多数检测机构的样本采集管均含胍盐保存液,对于含胍盐保存液的咽拭子样本是否需要进一步高温灭活的意见未统一。尚无研究表明含胍盐保存液的咽拭子样本经高温水浴灭活处理后是否对检验结果产生影响。为保证检验结果的一致性,实现检验结果互认,本研究特此展开。
1.资料与方法
1.1 一般资料:使用含胍盐保存液的样本管收集新疆乌鲁木齐地区2020年7-8月2019新型冠状病毒肺炎恢复期患者咽拭子样本170例,注意避免紫外光直接照射、酒精及含氯消毒剂的喷洒。
1.2仪器与试剂:咽拭子标本采集及样本保存管:百康芯(含胍盐保存液的样本管);核酸提取设备:重庆中元EXM3000核酸提取仪及其配套的磁珠法核酸提取试剂;核酸扩增仪:华大基因MA-6000;核酸扩增试剂:中山大学达安基因股份有限公司生产的新型冠状病毒2019‑nCoV核酸检测试剂盒(荧光PCR法)。恒温水浴箱:培英水浴箱。
1.3方法
1.3.1 标本采样:根据《医疗机构新型冠状病毒核酸检测工作手册(试行)》版规定,选择经过生物安全培训(培训合格)的医护人员进行咽拭子标本采集工作。在患者两侧咽扁桃体稍用力来回擦拭3次及以上,咽后壁上下擦拭3次及以上,将拭子头浸入含有2-3ml病毒保存液的样本管内保存,做好密闭。
1.3.2 分组及处理:将170例标本等量提取双份并分组:试验组:56℃恒温水浴孵化30分钟处理后提取核酸;对照组:室温放置30分钟后提取核酸。
1.3.3 核酸提取采用重庆中元EXM3000核酸提取仪及其配套的磁珠法核酸提取试剂,向反应孔内加入200μl咽拭子洗脱液,磁性颗粒吸附核酸(DNA/RNA)多聚基团,在高盐等特殊条件下释放核酸,通过吸附、分离等一系列改变液相条件下最终实现分离核酸,提取的病毒核酸立即使用。
1.3.4 核酸扩增:荧光RT-PCR检测使用中山大学达安基因股份有限公司生产的新型冠状病毒2019‑nCoV核酸检测试剂盒(荧光PCR法)。FAM通道检测N基因,VIC通道检测ORF1ab基因,Cy5通道检测人体上皮细胞RNP基因(内标基因)。按照试剂说明书进行相关操作,每批次携带阴阳质控保证检测结果的准确性。结果判断标准:阳性样本:检测样本在FAM和VIC通道Ct值≤40且有明显的扩增曲线;阴性:检测样本在FAM和VIC通道无扩增曲线或Ct值>40。
1.4 统计学分析:采用SPSS17.0进行统计学分析,试验组和对照组阳性率分析采用卡方检验,以P<0.05为具有统计学差异。
结果
2.1 对照组阳性标本检出率显著高于经56℃水浴灭活病毒处理的试验组,差异具有统计学意义(P<0.05),结果见下图1.
图1:对照组与试验组阳性例数统计
试验组 | 对照组 | 合计 | |
+ | - | ||
+ | 23 | 23 | 46 |
- | 0 | 124 | 124 |
合计 | 23 | 147 | 170 |
2.2两组样本人体上皮细胞RNP基因(内标基因)均呈现明显典型的扩增信号,表明样本取材及核酸提取质量均符合要求[6];对照组结果分析:46例阳性标本中,单N基因阳性32例,N基因和ORF1ab基因同时阳性14例;未见VIC通道检测ORF1ab单基因阳性;试验组结果分析:单N基因阳性14例,N基因和ORF1ab基因同时阳性9例;经高温灭活处理的咽拭子标本,N基因由阳变阴的标本23例(占比50%),ORF1ab基因由阳变阴的标本6例(占比42.86%);受到干扰的样本Ct值均在36以上,即反应体系中起始模板量较低的样本(通常认为是弱阳性标本/灰区标本)。结果见图2.
图2:试验组与对照组相关基因核酸检测Ct值
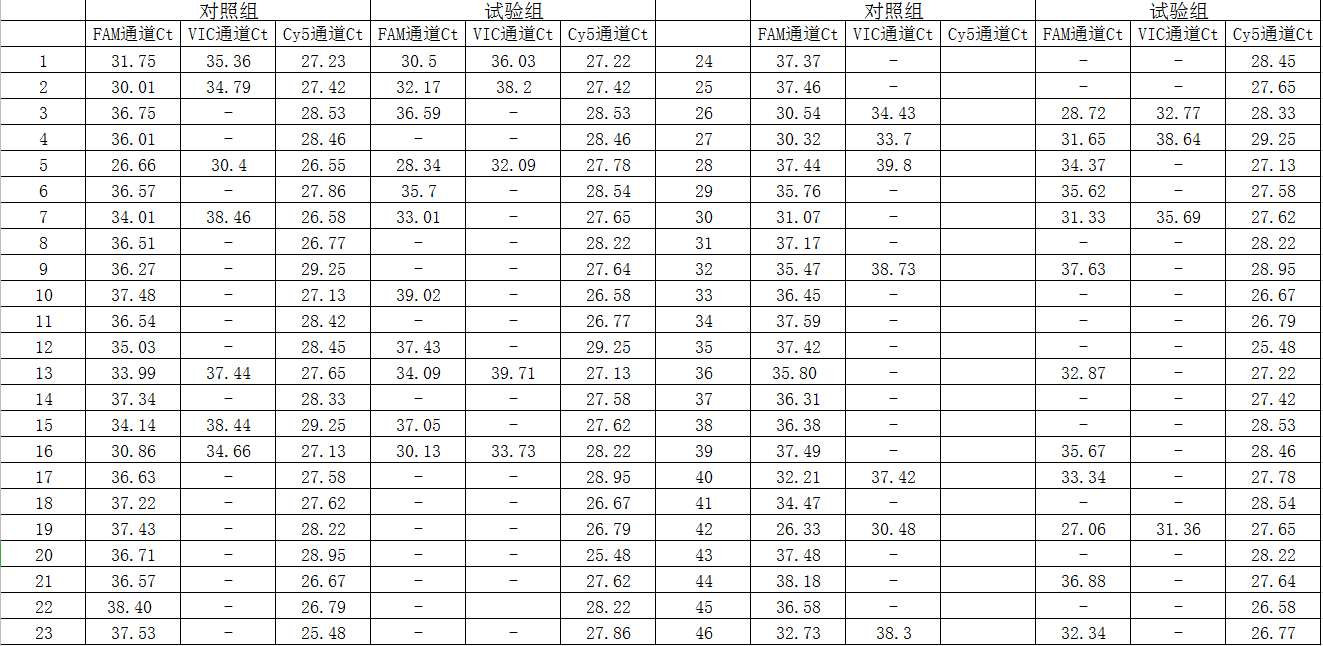
注:-代表阴性结果
3.讨论
2019‑nCoV是冠状病毒属的一种新毒株[7],对紫外线和热敏感;56℃ 30min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂均可有效灭活病毒[8]。选择含有胍盐的病毒保存液不仅可以对2019-nCov产生蛋白变性作用,降低感染风险;还具有抑制核糖核酸酶的作用,从而保证释放出来的病毒核酸不被降解[5]。本次研究结果显示:1.含胍盐保存液的咽拭子样本经56℃水浴灭活处理30分钟后导致假阴性结果增多,认为在采用56℃水浴灭活处理新型冠状病毒核酸样本时,应注意患者样本采集管是否含有胍盐保存液,避免试验结果受到干扰。2.经高温灭活处理的咽拭子标本N基因由阳变阴的标本23例,ORF1ab基因由阳变阴的标本6例,两种基因受到干扰的程度不同,初步推测与下列因素有关:a.N基因扩增模板稳定性较弱;b.N基因含量远多于ORF1ab基因。3.本次研究结果中未见VIC通道检测ORF1ab单基因阳性,ORF1ab基因阳性检出频率也低于N基因。考虑到本研究对170份2019‑nCoV患者咽拭子样本的检测结果进行分析,样本数量有限,不能有效地评价试剂的敏感性和特异性;同时我们仅使用达安基因股份有限公司所生产试剂的其中一个批号,并不能完全代表该品牌整体检测性能。如有条件,需选择同一试剂的多个批次进行试验,以满足临床检测所需。
根据《新型冠状病毒肺炎诊疗方案(试行第七版)》[9],新型冠状病毒肺炎患者的治疗与出院标准为:1. 体温恢复正常3天以上;2. 呼吸道症状明显好转;3. 肺部影像学显示急性渗出性病变明显改善;4. 连续两次痰、鼻咽拭子等呼吸道标本核酸检测阴性(釆样时间至少间隔24小时)。患者2019‑nCoV核酸检测结果就显得尤为重要。既要以减少假阴性结果,尽快筛检病毒感染者为主要目标[10-11],同时要兼顾实验室人员生物安全。后续会继续研究不同标本来源(如鼻拭子、粪便标本[12-15]等)、不同核酸扩增试剂在不同2019‑nCoV灭活处理方式下的阳性检出率,以期寻找到既能有效保护实验室生物安全,又可以对患者不同类型标本影响减至最小的一种病毒灭活方式。
参考文献:
中华医学会检验分会.2019新型冠状病毒肺炎临床实验室生物安全防护专家共识[J].中华检验医学杂志,2020,43(3):203-206.
中华人民共和国国家卫生健康委员会.新型冠状病毒实验室生物安全指南(第二版)的通知(国卫办科教函[2020]70号)[S].2020-01-23.
张沁欣,赵庆顺. 病毒核酸提取前的高温灭活过程显著降低可检出病毒核酸模板量[J].ChinaXiv:202002.00034,2020.
段秀枝.王旭楚.俞攀等.病毒灭活处理对2019新型冠状病毒核酸检测弱阳性结果的影响[J].中华检验医学杂志,2020,43(4):358-363.
姜蕾,张丽媛等.两种灭活方法对2019新型冠状病毒咽拭子标本病毒核酸检测结果的影响[J].分子诊断与治疗杂志,2020,12(4)410-413.
[6] 张乐海. 2019新型冠状病毒的基因组学初探[ J]. 国际流行病学传染病学杂志,2020(47):1.
[7] Zhu N, Zhang D, Wang W, et al. A novel coronavirus from
patients with pneumonia in China, 2019[J]. N Engl J Med, 2020.
[8] 国家卫生健康委办公厅.新型冠状病毒肺炎防控方案(第五版).国卫办疾控函〔2020〕156号[S]. 2020-2-21.
[9] 国家卫生健康委办公厅.新型冠状病毒肺炎诊疗方案(试行第七版)[J].传染病信息2020,33(1)1-6,26.
[10] HuiDavid S,IAzharEsam,MadaniTariqA,et a1.The con—
tinuing 2019一nCoV epidemic threat of novel coronaviruses to
global health—The latest 2019 novel coronavirus outbreak in
Wuhan,China[J ].Int J infect Dis:IJID:official publication
of the International Society for Infectious Diseases,2020,91:246-246.
[11] Wang D,Hu B,et a1.Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan,China.JAMA.2020 Feb 7:10.1001/jama.2020.1585.
[12] 任彬彬,陈海君,张德河,等.新型冠状病毒肺炎恢复期咽拭子核酸检测阴性但粪便检测阳性三例分析[J].中华临床感染病杂志.2020,13(1):33-35,38.
[13] Yeo C,kaushal S,Yeo D.Enteric involvement of coronavirus-es:is faecal-oral transmission of SARS-Cov-2possible?[J].Lancet Gastroenterol Hepatol,2020,5(4) 335-337.
[14] 杨智炜,李千文,戴小灵,等.新型冠状病毒肺炎咽拭子核酸检测转阴但粪便核酸检测仍阳性三例[J].中华消化杂志,2020,40(2):77-79.
[15] Talha K B.Coronavirus in China[J].News,2020,8(3):238.
第一作者:汤新乐,本科学历,初级检验医师
通信作者:梁静,本科学历,主任检验师,硕士研究生导师,研究方向:临床免疫学