大唐淮南洛河发电厂 安徽淮南 232000
摘 要:煤炭燃烧反应过程当中产生的SOx会对相关设备产生危害,同时造成周边环境的污染,因此,研究煤中硫转化以及对煤炭脱硫处理显得至关重要。以添加不同比例CaO的A煤为研究对象,对高温煤灰气相含硫化合物进行分析。结果表明:在弱还原性气氛(CO:CO2=6:4)下,A煤灰高温下硫主要转化为气相COS,其次为S2、SO2,以及少量的SO;从1000℃到1500℃,添加相同比例CaO的A煤中析出S的总量呈现先降低后增加的趋势,COS含量随温度升高而降低,SO2、SO含量随温度升高而增加,S2含量则呈现先增加后降低的趋势。
关键词:硫转化;高温煤灰;弱还原性气氛
在煤的转化及利用过程中,煤中硫的存在给全球带来严重的环境污染,成为制约煤炭开发和利用的重要因素。据国家环境保护总局统计,我国的大气环境污染仍以煤烟型为主,主要污染物为总悬浮颗粒物和二氧化硫。从资源的可持续发展和环保的角度考虑,若能通过深入探索气化过程含硫化合物生成特性及影响其生成的因素,从中寻求途径以减少气化系统本身气态含硫化合物的生成量,则可降低后续脱硫工艺投资成本,有效减少大气污染。因此,国内外许多学者对主要气态含硫化合物的生成特性都进行了试验研究[1-3]。
作为控制酸沉降等环境问题的主要策略之一就是降低SO2的排放量。目前控制燃煤SO2污染的方法主要是向煤中添加固硫剂的燃烧中脱硫技术。以石灰石或石灰为脱硫剂,省去了设备与操作费用而受到诸多学者关注。Fenouil等[4]在管式反应器中进行了三种钙系脱硫剂(石灰石、白云石灰石、白云石)的高温脱硫比较。在CaCO3锻烧温度以上,上述三种脱硫剂均可使CaCO3完全转化成CaS。Hartman M等[5]对金属氧化物脱硫剂进行了热力学计算,结果表明CaO在众多的金属氧化物脱硫剂中,可以达到的最小平衡体积分数仅次于V2O3和ZnO。
由于煤的组成并不是单一化合物,气化炉内的气化反应十分复杂,鉴于此限制,对A煤组成进行适当简化,分析气化过程中含硫化合物的生成转化特征,旨在研究不同温度下含硫化合物的平衡分布规律以及CaO对主要含硫生成物的影响。
1 实验部分
以A煤为研究对象,对其进行元素分析和灰成分分析,结果如表1所示。
表1 A煤元素分析及灰成分分析
SiO2 | Al2O3 | Fe2O3 | CaO | MgO | K2O | SO3 | Cad | Had | Oad | St,ad |
52.83 | 35.57 | 4.56 | 4.89 | 0.90 | 1.02 | 0.24 | 74.64 | 3.04 | 2.55 | 0.72 |
2 含硫化合物气相分布
煤气化反应体系经热力学平衡计算后,最终反应产物体系由502种化合物组成,其中含硫化合物种类达十余种,本文选择摩尔数量级>10−7的主要气相含硫化合物进行分析讨论。图1中(a)、(b)、(c)分别为A煤添加0%、2%、4%CaO在不同温度下气相含硫化合物分布。
(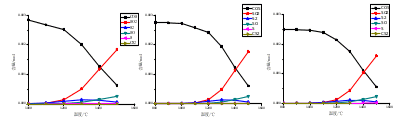 a) A煤 (b) A煤+2%CaO (c) A煤+4%CaO
a) A煤 (b) A煤+2%CaO (c) A煤+4%CaO
图1 不同温度下气相含硫化合物分布
从图1可以看出,在弱还原性气氛(CO:CO2=6:4)下,对于不同添加量CaO的A煤,均有:煤灰中硫主要转化为气相COS,其次为S2、SO2,以及少量的SO;且从1000℃至1500℃,COS含量随温度升高而降低,SO2、SO含量随温度升高而增加,S2含量则呈现先增加后降低的趋势。
煤在还原性气氛下燃烧时,首先是挥发分热解释出,并着火燃烧。当挥发分接近燃尽时,黄铁矿才可能和余下的氧气反应。由于在还原态下燃烧,氧气供给太少,以致挥发份燃尽后,氧气已所剩无几,这时黄铁矿硫的释出绝大部分是靠热分解进行的,在还原态气氛下,FeS2可被分解还原为FeS:
F eS2+C FeS+COS (1)
eS2+C FeS+COS (1)
上述反应所生成的FeS在还原性气氛下还能继续反应,还原出单质铁,反应式为:
F eS+CO Fe+COS (2)
eS+CO Fe+COS (2)
燃烧室中的CaO与以上反应中生成的COS进行反应
C aO+COS CaS+CO2 (3)
aO+COS CaS+CO2 (3)
因此,在弱还原性气氛(CO:CO2=6:4)下,A煤中硫主要转化为气相COS,而CaO的存在,消耗了部分COS,使得COS含量呈现下降趋势。
经过这些反应硫以CaS的形式被固定下来。
3 结论
在给定气化条件下对添加不同比例CaO的A煤高温气相含硫化合物进行了模拟研究,得出以下结论:
在弱还原性气氛(CO:CO2=6:4)下,A煤中硫主要转化为气相COS,其次为S2、SO2,以及少量的SO;
从1000℃到1500℃,添加相同比例CaO的A煤中析出S的总量呈现先降低后增加的趋势,COS含量随温度升高而降低,SO2、SO含量随温度升高而增加,S2含量则呈现现增加后降低的趋势;
参考文献
[1]王卫良,吕俊复,张建胜,刘青,岳光溪,沈解忠,苏小平.还原条件下煤中硫的转化[J].动力工程,2006,(03):427-431.
[2]Mullens S, Yperman J, Reggers G, et al. A study of the reductive pyrolysis behaviour of sulphur model compounds[J]. Journal of Analytical & Applied Pyrolysis, 2003, 70(2):469-491.
[3]Skhonde M P, Matjie R H,Bunt J R, et al. Sulfur Behavior in the Sasol−Lurgi Fixed-Bed Dry-Bottom Gasification Process[J]. Energy & Fuels, 2009, 23(1):229-235.
[4]Fenouil L A, Lynn S. Study of Calcium-Based Sorbents for High-Temperature H2S Removal. Comparison of Calcium-Based Sorbents for Coal Gas Desulfurization[J]. Industrial & Engineering Chemistry Research, 1995, 34(7):2343-2348.
[5]Hartman M, Svoboda K, O. Trnka A, et al. Reaction between Hydrogen Sulfide and Limestone Calcines[J]. Ind.eng.chem.res, 2002, 41(10):2392-2398.
[6]黄亚继,金保升,仲兆平,等.煤气化过程中痕量元素迁移规律与气化温度的关系[J].中国电机工程学报, 2006, 26(4):10-15.
[7]王勤辉,沈洵,骆仲泱,等.新型近零排放煤气化燃烧利用系统[J].动力工程学报, 2003, 23(5):2711-2715.
[8]Kuramochi H, Wu W, Kawamoto K. Prediction of the behaviors of H2S and HCl during gasification of selected residual biomass fuels by equilibrium calculation[J]. Fuel, 2005, 84(4):377-387.