1, 齐齐哈尔医学院附属第三医院 2. 锦州医科大学医疗学院
背景:文献报道显示:富血小板血浆-琼脂糖凝胶支架制备方法相对简单,对于设备要求较低,用于软骨缺损中能促进缺损愈合,但是该结论尚未得到证实。
目的:探讨基于富血小板血浆-琼脂糖凝胶支架制备方法、理化性能及在促进软骨缺损中的修复效果。
方法:①支架制备。购置7-9月龄成年新西兰大白兔30只,10只用于软骨细胞的分离、培养,制备富血小板血浆,接种在琼脂糖凝胶及富血小板血浆中,制备琼脂糖凝胶支架及富血小板血浆-琼脂糖凝胶支架,测定支架的理化性能。②取剩余20只成年新西兰大白兔,制备兔股骨远端关节面骨软骨缺损模型,随机分为琼脂糖凝胶支架组(n=10)和复合支架组(n=10)。琼脂糖凝胶支架组采用琼脂糖凝胶支架进行修复,复合支架组采用富血小板血浆-琼脂糖凝胶支架修复,比较2组修复效果。
结果和结论:扫描电镜观察显示:凝胶支架体外培养第一天后,两种凝胶中的软骨细胞分布相对稀疏,多为椭圆形将软骨细胞接种在支架上,细胞从第1天-21天保持增长状态,细胞在两种支架上起初OD值差异无统计学意义(P>0.05);细胞培养7-21天细胞在复合支架组上增殖率,高于琼脂糖凝胶支架组(P<0.05);复合支架组在第4周及第8周支架中GAG、胶原及DNA含量,高于琼脂糖凝胶支架组(P<0.05);复合支架组修复4周后新西兰大白兔软骨缺损部位得到愈合;修复8周后缺损部位修复,新生组织部位与正常组织无明显界限,光泽;琼脂糖凝胶支架组修复4周后缺损部位明显,但是缺损部位大小较小;修复8周后缺损部位愈合,但是与正常组织界限明显;复合支架组修复4周后支架部分降解,可见残余材料,与软骨下骨间间隙消失;修复8周后支架完全降解,高度与正常软骨组织一致,软骨下骨链接紧密,多以透明软骨细胞为主。琼脂糖凝胶支架组修复4周后支架开始降解,与周围软骨结合较好,但是软骨下骨存在较大间隙;修复8周后缺损部位得到修复,但是存在明显凹陷,无光泽。提示:富血小板血浆-琼脂糖凝胶支架能促进缺损部位修复。
关键词:富血小板血浆;琼脂糖凝胶支架;制备方法;理化性能;股骨远端关节面骨软骨缺损;修复效果;软骨细胞;缺损部位
主题词:富血小板血浆;琼脂糖凝胶支架;软骨细胞;缺损部位;理化性能
Physical and chemical properties of bioactive scaffolds based on platelet rich plasma and its repair mechanism in promoting cartilage defects
ABSTRACT
Background:studies have shown that platelet rich plasma agarose gel scaffold preparation method is relatively simple, low requirements for equipment, for cartilage defect can promote the healing of the defect, but the conclusion has not been confirmed.
Method: preparation of scaffold. The purchase of 7-9 month old adult mini pigs 30, 10 for the isolation and culture of chondrocytes, preparation of platelet rich plasma, seeded in agarose gel and platelet rich plasma, preparation of the gel scaffold and platelet rich plasma on agarose gel scaffold, physicochemical properties of scaffolds were determined. Take the remaining 20 adult mini pigs, preparation of mini pig distal femoral articular surface cartilage defect model, and randomly pided into agarose gel scaffold group (n=10) and composite scaffold group (n=10). The agarose gel scaffold group was repaired with agarose gel scaffold, and the composite group was treated with platelet rich plasma agarose gel scaffold. The repair effect of the 2 groups was compared.
Results and conclusion: scanning electron microscopy showed: after the first day of training two gel gel scaffold in vitro, the chondrocytes were sparse, mostly oval cartilage cells were seeded on the scaffolds, cells from first -21 days to keep the growth state of cells in two scaffolds at first od showed no significant difference (P>0.05); 7-21 cells in the scaffold group on the proliferation rate of cells, higher than that of agarose gel scaffold group (P<0.05); composite scaffold group and GAG, collagen and DNA content in 8 weeks in support in fourth weeks, higher than that of agarose gel scaffold group (P<0.05); composite scaffold repair group 4 weeks after the mini pig defect healed; repair after 8 weeks of repair of the defect site, no boundaries, newborn tissue and normal tissue luster; agarose gel scaffold repair group 4 weeks after the defect is obvious, but the lack of Small size of the damage site; repair defect after 8 weeks of healing, but with normal tissue boundaries; composite scaffold repair group 4 weeks after stent degradation, visible residual material, disappear with subchondral bone gap repair; 8 weeks after complete degradation of the stents height of normal cartilage and subchondral bone tissue, closely link the hyaline cartilage cells. Agarose gel scaffold repair group 4 weeks after the stent has good degradation, combined with the surrounding cartilage, but there is a big gap of subchondral bone defect repair; 8 weeks after the repair, but there are obvious depression, dull. Conclusion: platelet rich plasma agarose gel scaffold can promote the repair of defect sites.
Keywords: platelet rich plasma; agarose gel scaffold; preparation method; physicochemical properties; distal femoral articular bone cartilage defect; repair; chondrocyte; defect
0 引言 Introduction
软骨缺损在临床上比较常见,患者发病后如果得不到及时有效的治疗,将会引起软骨组织缺损,导致组织间疼痛,造成患者功能障碍、活动不便,影响患者健康[1]。从人体解剖学角度来说,软骨缺损位置特殊,该部位缺乏血管、神经,缺损后再生能力有限,难以实现自身修复[2]。同时,患者缺损后由于长时间缺乏理想的方法治疗,容易引起关节退变、骨性关节炎,加剧疾病的发展。目前,临床上对于软骨缺损治疗方法较多,包括:自体软骨细胞移植、微骨折术等
[3]。自体软骨细胞移植是最为理想的修复移植入,具有良好的生物相容性,促进缺损部位愈合,但是修复效果效果;而微骨折术则具有创伤、并发症发生率高等特点难以推广应用[4]。
随着医疗技术的不断发展,软骨支架在软骨缺损中得到应用,人工合成材料包括:聚乳酸、聚乙二醇等;天然支架材料则包括:胶原、壳聚糖、琼脂糖等,但是临床软骨缺损修复时选择何种支架尚存在较大的争议。富血小板血浆是一种由多种生长因子浓缩的集合,包括:血小板衍生因子、转化生长因子、血管内皮生长因子等[5]。文献报道显示[6]:富血小板血浆能促进软骨细胞的增殖、分化,利于细胞外基质的形成,而单纯的富血小板血浆或富血小板血浆结合其他支架均有报道。国外学者研究显示:富血小板血浆是一种资源丰富的生长因子,能促进软骨细胞分泌,利于软骨缺损的修复。相关学者研究显示[7]:富血小板血浆-琼脂糖凝胶支架具有可塑性强、三维形成、创伤性小、无免疫反应及良好的力学性能等特点,但是,临床上对于富血小板血浆-琼脂糖凝胶支架制备方法、理化性能及在软骨缺损中的修复基质尚缺乏报道[8]。本课题取2019年5月-2021年05月医院进行的新西兰大白兔30只作为研究对象,制备兔股骨远端关节面骨软骨缺损模型,探讨基于富血小板血浆-琼脂糖凝胶支架制备方法、理化性能及在促进软骨缺损中的修复效果。
1 对象和方法 Subjects and methods
设计:细胞及支架制备试验。
时间及地点:于2019年5月-2021年05月齐齐哈尔医学院附属第三医院实验室完成。
对象:取新西兰大白兔30只作为研究对象,雌雄随机,7月龄,体重(18-20)kg,平均(18.5±0.60)kg,所选动物均由医院动物实验中心提供。实验过程中对成年新西兰大白兔饲养、处理均符合《关于善待实验动物的指导下意见》[9-10]相关规则,合格证号为SCXK2014-0011,新西兰大白兔均给予饲精制颗粒饲料,自由饮水。所有试验均通过医院动物委员会批准同意。
主要仪器和试剂:为了保证试验的顺利完成,采用的主要仪器和试剂主要由不完全低糖DMEM培养基、胰蛋白酶-EDTA消化液、青链霉素双抗液、M199培养基、低熔点琼脂糖、II型胶原抗体、活体组织打孔器、倒置显微镜等,相关试剂和仪器厂家如下,见表1。
表1 主要仪器和试剂
Table 1 Main instruments and reagents
主要仪器和试剂 | 厂家/批号 |
不完全低糖DMEM培养基 | 美国Gibco公司 |
胰蛋白酶-EDTA消化液 | 美国Gibco公司 |
青链霉素双抗液 | 美国HyClone公司 |
低熔点琼脂糖 | 美国Sigma-Aldrich公司 |
II型胶原抗体 | 英国Abcan公司 |
倒置显微镜 | 日本BX53 Olypus公司 |
活体组织打孔器(6mm/3mm) | 美国Corning公司 |
手术器械一套 | 医院提供 |
注:研究中所使用的仪器和试剂均由相应公司提供。
方法:
软骨细胞分离、培养:取10只成年新西兰大白兔,采用过量麻醉处死新西兰大白兔,对新西兰大白兔双下肢切取并进行消毒,无菌条件 下打开膝关节腔,切除邻近的骨膜及其他软组织,采用手术刀切除膝关节面软骨,将其切成1mm左右的碎片,37℃,5%CO2培养箱中培养,加入0.4%II型胶原酶进行16h消化,在150um滤网下过滤,5min离心,速度为1200rpm,去除上层清液,采集软骨细胞,采用PBS缓冲液进行冲洗,根据50000细胞/cm2密度接种在培养皿中,加入10.0%胎牛血清的DMEM培养,每2-3天换液一次,待细胞生长融合80.0%传代培养,取第三代细胞备用[11-12]。
富血小板血浆的制备:采用50mL无菌针筒从新西兰大白兔耳缘静脉中抽取50mL静脉血,轻轻摇晃针筒,使得血液与枸缘酸钠抗凝充分混合,取100uL血液用于血小板计数。将获得的血液5min离心,速度为2000rpm,获得三层血液:红细胞层(下)、白膜层(中)及血浆层(上),取上层血细胞,10min离心,速度为2000rpm获得贫血血小板血浆及下层血小板块,将上层移到另一只离心管中(用于调节富血小板血浆浓度)。取下层血小板块重悬后制备富血小板血浆,计数后备用,见图1
[13-14]。

图1 富血小板血浆的制备
Figure 1 Preparation of platelet rich plasma
富血小板血浆-琼脂糖凝胶支架制备:取制备的第三代软骨细胞,调整细胞密度为2×107细胞/mL,与PBS缓冲液和富血小板血浆混合,然后在40℃条件下分别加入等体积的、浓度为4%的琼脂糖溶液,制备出浓度为2%琼脂糖与细胞混悬液。将两种混悬液放入不锈钢中,待温度降低到室温后,采用血管钳将凝胶取出,放入含有10.0%胎牛血清的DMEM培养液中进行7周培养,每3天换液一次,培养完毕后PBS冲洗,干燥后、备用,见图2[15-16]。

图2 富血小板血浆-琼脂糖凝胶支架制备
Figure 2 preparation of platelet rich plasma agarose gel scaffold
图注:A图为琼脂糖凝胶支架不同角度形态;B图为富血小板血浆-琼脂糖凝胶支架不同角度形态。
股骨远端关节面骨软骨缺损模型制备及处理:取剩余20只新西兰大白兔,手术前30min肌肉注射抗生素预防感染,称重仪采用戊巴比妥钠腹腔注射麻醉,沿着单侧膝部髌骨内缘作长为2.5cm的纵行手术切口,将髌骨牵向外侧,利用小骨凿在股骨内、外侧踝间关节中部作深度为3mm的骨软骨缺损模型,缺损大小为4mm×4mm,建立新西兰大白兔股骨远端关节面骨软骨缺损模型。新西兰大白兔模型建立完毕后,取琼脂糖凝胶支架及富血小板血浆-琼脂糖凝胶支架,将其修剪成大小为4mm×4mm。琼脂糖凝胶支架组采用琼脂糖凝胶支架进行修复,复合支架组采用富血小板血浆-琼脂糖凝胶支架修复。修复关节囊,保证髌骨在正确的解剖位置,关闭手术切口,术后所有新西兰大白兔均单笼饲养,不进行术肢的固定,自由活动、取食,术后第二天采用抗生素预防感染[17-18]。
观察指标:
支架大体观察。取制备的琼脂糖凝胶支架及富血小板血浆-琼脂糖凝胶支架,进行简单修剪后,采用离子溅射仪进行喷金镀膜,采用扫描电镜观察2种材料的形态、结构[19]。
细胞在支架上的增殖。细胞接种在支架上第0、1、4、5、10、14及21天才有MTT法完成细胞增殖率测定,并且在酶标仪550nm波长下读取相关数据[20]。
理化性能。2组支架在体外培养4周、8周后,取标本对其理化性能进行测定,包括:糖胺聚糖含量(GAG)、总胶原含量及DNA含量,相关操作步骤必须严格遵循仪器、试剂盒操作说明进行[21]。
大体观察。2组新西兰大白兔修复4周、8周各处死5只,取出缺损部位进行大体观察。
HE染色。在大体观察新西兰大白兔基础上,取修复部位组织,制备4um切片,染色前采用二甲苯进行固定,常规HE,倒置显微镜下观察缺损部位情况[22]。
统计学处理:采用SPSS18.0软件处理,计数资料采用n(%)表示,行卡方检验,计量资料采用(![]() )表示,行t检验,P<0.05提示有统计学意义。
)表示,行t检验,P<0.05提示有统计学意义。
2结果Results
2.1 实验动物数量分析:参加的成年新西兰大白兔30只,成年新西兰大白兔30只全部进行结果分析数量,中途无脱落。
2.2 琼脂糖凝胶支架及富血小板血浆-琼脂糖凝胶支架大体观察 扫描电镜观察显示:凝胶支架体外培养第一天后,两种凝胶中的软骨细胞分布相对稀疏,多为椭圆形,但是富血小板血浆-琼脂糖凝胶支架中含有大量血小板黏附,并且存在许多细胞外基质分泌;琼脂糖凝胶支架软骨细胞及基质相对较少,见图3。
 图3 琼脂糖凝胶支架及富血小板血浆-琼脂糖凝胶支架大体观察(×200)
图3 琼脂糖凝胶支架及富血小板血浆-琼脂糖凝胶支架大体观察(×200)
Figure 3 agarose gel scaffold and platelet rich plasma agarose gel scaffold (× 200)
图注:A图为富血小板血浆-琼脂糖凝胶支架SEM形态;B图为琼脂糖凝胶支架SEM形态。
2.3 细胞在支架上的增殖情况 将软骨细胞接种在支架上,细胞从第1天-21天保持增长状态,细胞在两种支架上起初OD值差异无统计学意义(P>0.05);细胞培养7-21天细胞在复合支架组上增殖率,高于琼脂糖凝胶支架组(P<0.05),见图4。
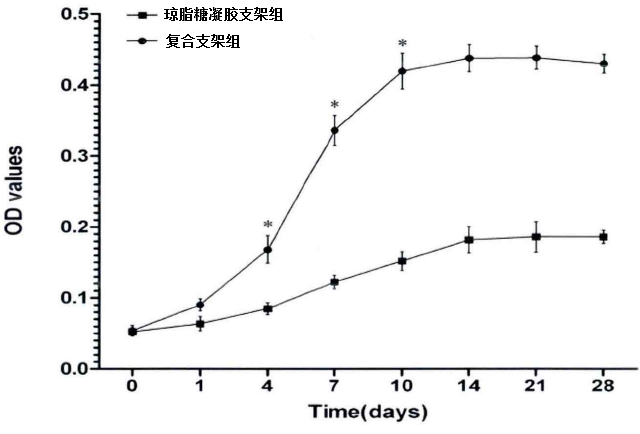
图4 细胞在支架上的增殖情况
Figure 4 proliferation of cells on scaffolds
2.4 2组支架理化性能比较 复合支架组在第4周及第8周支架中GAG、胶原及DNA含量,高于琼脂糖凝胶支架组(P<0.05),见表2。
表2 2组支架理化性能比较
Table 2: Comparison of physical and chemical properties of two groups of scaffolds
组别 | GAG(%) | 胶原(%) | DNA | |||
第4周 | 第8周 | 第4周 | 第8周 | 第4周 | 第8周 | |
复合支架组 | 1.25±0.07 | 2.67±0.15 | 1.20±0.07 | 2.73±0.14 | 0.01±0.006 | 0.065±0.003 |
琼脂糖凝胶支架组 | 0.45±0.03 | 0.87±0.03 | 0.46±0.07 | 0.82±0.04 | 0.006±0.005 | 0.013±0.002 |
t | 19.281 | 20.444 | 21.511 | 18.256 | 22.018 | 18.413 |
P | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 | <0.05 |
2.5 2组支架修复迷你猪缺损部位大体观察 复合支架组修复4周后新西兰大白兔缺损部位得到愈合,但是新生组织与正常组织界限尚明显;修复8周后缺损部位修复,新生组织部位与正常组织无明显界限,光泽;琼脂糖凝胶支架组修复4周后缺损部位明显,但是缺损部位大小较小;修复8周后缺损部位愈合,但是与正常组织界限明显,见图5。
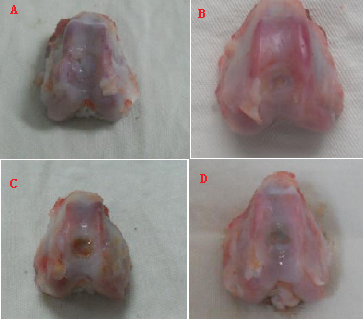
图5 2组支架修复新西兰大白兔缺损部位大体观察
Figure 5 Group 2 scaffold repair mini-pig defect site in general observation
图注:A图为复合支架组修复4周大体观察;B图为修复8周大体观察;C图为琼脂糖凝胶支架组修复4周大体观察;D图为琼脂糖凝胶支架组修复8周大体观察。
2.6 2组支架修复4周、8周组织学比较 复合支架组修复4周后支架部分降解,可见残余材料,与软骨下骨间间隙消失;修复8周后支架完全降解,高度与正常软骨组织一致,软骨下骨链接紧密,多以透明软骨细胞为主。琼脂糖凝胶支架组修复4周后支架开始降解,与周围软骨结合较好,但是软骨下骨存在较大间隙;修复8周后缺损部位得到修复,但是存在明显凹陷,无光泽,见图6。
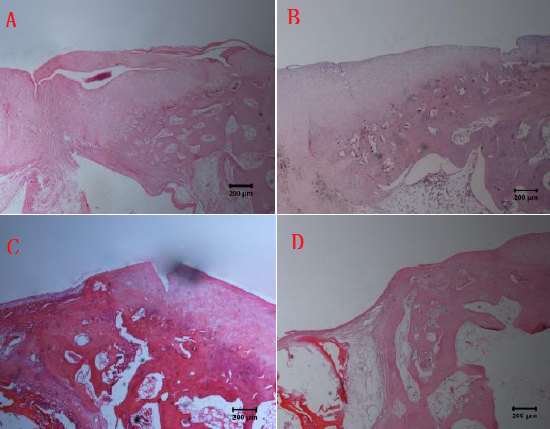
图6 2组支架修复4周、8周组织学比较
Figure 6 group of 4 weeks 4 weeks, 8 weeks histological comparison
图注:A图为复合支架组修复4周HE染色;B图为修复8周HE染色;C图为琼脂糖凝胶支架组修复4周HE染色;D图为琼脂糖凝胶支架组修复8周HE染色。
3 讨论 Discussion
关节软骨自身修复能力非常有限,损伤边缘的正常关节软骨迁移到关节软骨下骨修复整层关节软骨缺损受到的影响因素较多,包括:年龄、缺损大小、缺损部位等。临床上,软骨缺损诱因相对较多,包括:疾病、创伤、炎症、损伤面积等,导致临床缺损修复后生物力学、生化等特性方面难以达到预期的修复效果[23]。近年来,随着医疗技术的不断发展,相关学者报道了富血小板血浆在骨、肌肉、软骨损伤中具有良好的修复效果,用于颅骨缺损中能成功诱导骨的再生。国外学者报道了采用富血小板血浆结合胶原能促进猪前交叉韧带的生物力学性能[24]。
结合临床及实验研究中富血小板血浆及琼脂糖的成功运用,本课题中取新西兰大白兔软骨细胞接种在富血小板血浆-琼脂糖凝胶中制备富血小板血浆-琼脂糖凝胶支架,结果显示:扫描电镜观察显示:凝胶支架体外培养第一天后,两种凝胶中的软骨细胞分布相对稀疏,多为椭圆形,但是富血小板血浆-琼脂糖凝胶支架中含有大量血小板黏附,并且存在许多细胞外基质分泌;琼脂糖凝胶支架软骨细胞及基质相对较少。富血小板血浆中含有多种对于组织愈合有价值的因子,包括:TGF-β、PDGF和IGF-1含量[25]。文献报道显示[26]:TGF-β能促进软骨细胞增殖及细胞外基质分泌;而PDGF和IGF-1则能刺激细胞的增殖,但是效果比TGF-β弱,三者的联合能促进细胞外基质的合成。本研究中,将软骨细胞接种在支架上,细胞从第1天-21天保持增长状态,细胞在两种支架上起初OD值差异无统计学意义(P>0.05);细胞培养7-21天细胞在复合支架组上增殖率,高于琼脂糖凝胶支架组(P<0.05)。由此看出:制备的富血小板血浆-琼脂糖凝胶支架有助于细胞的增殖,能为细胞的生长提供足够的空间,其性能明显优于单一的琼脂糖凝胶支架[27]。本研究中,复合支架组在第4周及第8周支架中GAG、胶原及DNA含量,高于琼脂糖凝胶支架组(P<0.05)。由此看出:制备的复合支架中具有较高的胶原、糖胺聚糖及DNA,使得支架具有良好的性能,植入机体后并不会引起免疫排斥反应,有助于促进部位的修复[28]。
为了进一步验证制备的复合支架的修复性能,本课题成功制备新西兰大白兔股骨远端关节面骨软骨缺损模型,并在缺损部位分别植入琼脂糖凝胶支架和富血小板血浆-琼脂糖凝胶支架,结果显示:复合支架组修复4周后新西兰大白兔缺损部位得到愈合,但是新生组织与正常组织界限尚明显;修复8周后缺损部位修复,新生组织部位与正常组织无明显界限,光泽;琼脂糖凝胶支架组修复4周后缺损部位明显,但是缺损部位大小较小;修复8周后缺损部位愈合,但是与正常组织界限明显。通常认为:富血小板血浆中含有许多验证因子,如:白细胞介素1β、肿瘤坏死因子α,这些炎症因子是由于血浆中高浓度的白细胞的结果。将制备的富血小板血浆-琼脂糖凝胶支架运用于软骨缺损中能为软骨细胞的增殖、分化提供一个良好的环境,并且支架有助于软骨与正常软骨之间的整合,能促进软骨细胞的增殖及细胞外基质分泌,从而有助于软骨缺损部位的修复[29]。本研究中,复合支架组修复4周后支架部分降解,可见残余材料,与软骨下骨间间隙消失;修复8周后支架完全降解,高度与正常软骨组织一致,软骨下骨链接紧密,多以透明软骨细胞为主。琼脂糖凝胶支架组修复4周后支架开始降解,与周围软骨结合较好,但是软骨下骨存在较大间隙;修复8周后缺损部位得到修复,但是存在明显凹陷,无光泽。由此看出:新制备的复合支架有助于软骨缺损部位愈合,并且材料属于是一种高分子支架,植入机体后具有良好的生物降解特性,有助于缺损部位的愈合及修复
[30]。
综上所述,取新西兰大白兔软骨细胞接种在富血小板血浆-琼脂糖凝胶中制备富血小板血浆-琼脂糖凝胶支架,用于迷你猪股骨远端关节面骨软骨缺损中,能促进缺损部位愈合,具有广泛的应用前景。
4参考文献
[1]乔占清,张俊,马赛,马振亚,司远征,乔新明. 同种异体软骨细胞-聚羟基乙酸支架复合物修复甲状软骨缺损[J].中国组织工程研究,2016,20(12):1711-1717.
[2]李红喜,张睿,李华哲,等.软骨细胞联合BMP/bFGF移植对关节软骨损伤的修复作用[J].现代生物医学进展, 2013,13(22):4237-4241.
[3]Kiss A,Cucchiarini M,Menger MD,et al.Enamel matrix derivative inhibits proteoglycan production and articular cartilage repair, delays the restoration of the subchondral bone and induces changes of the synovial membrane in a lapine osteochondral defect model in vivo.J Tissue Eng Regen M.2014,8(1):41-49.
[4]陆兴,张永红,李二峰,等.羟基丁酸-羟基辛酸聚合物/胶原软骨组织工程支架的细胞亲和性[J].中国组织工程研究, 2014,18(12):1895-1900.
[5]Tang C,Xu Y,Jin C,et al.Feasibility of Autologous Bone Marrow Mesenchymal Stem Cell-Derived Extracellular Matrix Scaffold for Cartilage Tissue Engineering.Artificial Organs.2013,37(12):E179-E190.
[6]崔玉明,伍骥,胡蕴玉,等.聚乳酸/聚羟基乙酸共聚物修复髌股关节软骨缺损[J].中国组织工程研究与临床康复,2011,15(16):2877-2880.
[7]Lee CC,Lo Y,Ho LJ,et al.A New Application of Parallel Synthesis Strategy for Discovery of Amide-Linked Small Molecules as Potent Chondroprotective Agents in TNF-α-Stimulated Chondrocytes.PLoS One. 2016,11(3):e0149317.
[8]高天喜,常会敏,范敏杰,等.聚羟基脂肪酸酯的生物修饰及其生物相容性研究[J].中国修复重建外科杂志,2014,28(8):1018-1024.
[9]Anbarasan S,Baraneedharan U,Paul SF,et al.Low dose short duration pulsed electromagnetic field effects on cultured human chondrocytes: An experimental study.Indian J Orthop.2016,50(1):87-93
[10]Huang Z,Li J,Du S,et al.Effects of UCP4 on the Proliferation and Apoptosis of Chondrocytes: Its Possible Involvement and Regulation in Osteoarthritis.PLoS One.2016,11(3):e0150684.
[11]雍志军,贾帅军,韩林章,等.富血小板纤维蛋白对兔骨髓间充质干细胞成软骨分化的影响[J].现代生物医学进展, 2014, 14(8):1407-1410.
[12]张永涛.不连通双层PLGA支架负载自体骨髓间充质干细胞与富血小板血浆的复合体修复骨软骨缺损的实验研究[D].南方医科大学,2013.
[13]Yeh HY,Hsieh FY,Hsu SH.Self-patterning of adipose-derived mesenchymal stem cells and chondrocytes cocultured on hyaluronan-grafted chitosan surface.Biointerphases. 2016 5,11(1):011011
[14]Mueller M,Weinmann D,Toegel S,et al.Compounds from Caesalpinia sappan with anti-inflammatory properties in macrophages and chondrocytes.Food Funct. 2016,7(3):1671-1679.
[15]郑宇,党建军,金鸿宾,等. 组织工程软骨构建中不同支架材料的特征[J].中国组织工程研究,2016,20(3):423-429.
[16]Wei B, Jin C, Xu Y, et al. Effect of bone marrow mesenchymal stem cells-derived extracellular matrix scaffold on chondrogenic differentiation of marrow clot after microfracture of bone marrow stimulation in vitro. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2013,27(4):464-474.
[17]Bhumiratana S, Eton RE, Oungoulian SR, et al. Large, stratified, and mechanically functional human cartilage grown in vitro by mesenchymal condensation. Proc Natl Acad Sci U S A. 2014,111(19):6940-6945.
[18]贾敏,袁琨. 羟基乙酸负载软骨细胞组织工程软骨修复喉软骨缺损[J].中国组织工程研究,2016,20(47):7051-7056.
[19]郭霄飞,张永红,杜美丽,等.羟基丁酸与羟基辛酸共聚物一体化骨软骨组织工程支架的制备及性能[J].中国组织工程研究,2012,16(16):2865-2868.
[20]孙安科,李万同,刘松波,等.聚羟基烷酸酯聚合物负载软骨细胞修复同种异体喉软骨缺损[J].中国组织工程研究,2013,17(41):7181-7187.
[21]郭霄飞,张永红,杜美丽,等.羟基丁酸与羟基辛酸共聚物一体化骨软骨组织工程支架的制备及性能[J].中国组织工程研究,2012,16(16):2865-2868.
[22]Wei B,Jin C,Xu Y,et al.Effect of bone marrow mesenchymal stem cells-derived extracellular matrix scaffold on chondrogenic differentiation of marrow clot after microfracture of bone marrow stimulation in vitro. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2013,27(4):464-474.
[23]刘吉斌,侯连东,于强,等. 骨膜复合骨髓间充质干细胞和软骨细胞体内移植修复软骨缺损[J].中国组织工程研究,2015,19(3):364-369.
[24]徐立岩, 马剑雄,王颖,等.关节制动对大鼠膝关节软骨缺损修复的影响[J].中国组织工程研究,2016,20(37):5496-5503.
[25]Stumpfe ST,Pester JK,Steinert S, et al. Is there a correlation between biophotonical, biochemical,histological,and visual changes in the cartilage of osteoarthritic knee-joints? Muscles Ligaments TendonsJ. 2013,3(3):157-165.
[26]陈加荣,张余,黄华扬,等.磁力靶向传递SPIO标记的BMSC修复关节软骨缺损的研究进展[J].中国骨科临床与基础研究杂志,2014,6(2):118-122.
[27]杨建华,刘舒云,赵鹏,等.微球化人脐带Wharton胶间充质干细胞移植裸鼠皮下构建异位软骨[J].中国组织工程研究,2014,18(8):1179-1184.
[28]刘利兵,王成伟,高健,等.微骨折技术与骨软骨移植治疗关节软骨缺损[J].中国组织工程研究,2013,17(31):5735-5740.
[29]刘拴,杨洪平,张卫国.关节镜下关节清理术治疗膝关节骨性关节炎的疗效分析[J].实用临床医学杂志,2014,18(1):58-60.
[30]Ito Satoshi,Sato Masato,Yamato Masayuki,Mitani Genya,Kutsuna Toshiharu, Nagai Toshihiro,Ukai Taku,Kobayashi Miyuki,Kokubo Mami,Okano Teruo,Mochida Joji.Repair of articular cartilage defect with layered chondrocyte sheets and cultured synovial cells.Biomateria ls.2012,33(21):5278-5286.
黑龙江省省属高等学校基本科研项目,项目编号:2017-QYKYYWF-0763