健研检测集团有限公司 福建厦门 361000
摘 要:采用干法或半干法脱硫工艺时产生的粉煤灰含有半水亚硫酸钙,是导致水泥混凝土水化过程异常和强度下降的重要原因之一。现有的粉煤灰半水亚硫酸钙检测引用石膏方法,存在一定的缺陷,本文采用硫化物间接法测试粉煤灰中半水亚硫酸钙含量,提高实验的准确性。
关键词:粉煤灰;半水亚硫酸钙;测试
结合技术发展、应用需求和行业变化,国家于2017年重新修订颁布《用于水泥和混凝土中的粉煤灰》GB/T 1596-2017[1],新标准在粉煤灰的定义、技术要求、测试方法等方面进行了修订完善。其中,由于火电厂实施更加严格的环保标准,脱硫工艺大面积实施对粉煤灰品质造成影响,主要表现在引入大量的石膏和有害的半水亚硫酸钙。因此,新标准针对采用干法或半干法脱硫工艺时产生的粉煤灰新增加了对半水亚硫酸钙含量的技术要求。
粉煤灰半水亚硫酸钙测定方法引用的是石膏检测方法《石膏化学分析方法》GB/T 5484-2012[2],在日常检测过程中经常出现检测结果为负值、待测液体颜色过深无法判断检测终点等问题,国内外对于粉煤灰半水亚硫酸钙含量测定的研究并不多,因此急需对影响半水亚硫酸钙含量检测的因素进行探究,优化并寻找快速准确的试验方法。
干法工艺脱硫粉煤灰取自某电厂。所涉及的主要化学试剂有:亚硫酸钙、氯化钡溶液(100g/L)、非氧化性酸(盐酸、氢氟酸、醋酸、抗坏血酸、苯甲酸、单宁酸)、氧化物(过氧化氢、硝酸、高氯酸、磷酸、高锰酸钾)。
干法/半干法脱硫主要是将石灰石粉喷射到炉膛内,在高温下CaCO3立即分解成CaO并与烟气中的SO2反应生成CaSO4和CaSO3,由于该工艺过程CaCO3是过量的,因此收集得到的粉煤灰中,硫元素主要以CaSO4和CaSO3形式存在。[3-4] 其CaSO3中的S元素以正四价形式存在,较不稳定,在非氧化性酸条件下,受热易分解;在强氧化性物质存在条件下,易被氧化物氧化成CaSO4。根据以上CaSO4和CaSO3特性,设计了以下两个步骤的试验,用以得出粉煤灰中半水亚硫酸钙的含量。
第一步,通过称量一定质量的粉煤灰至300mL的烧杯中,加入已再次煮沸的蒸馏水使其分散后,加入过量的非氧化性酸,在烧杯上部倒扣一漏斗,往漏斗尾部持续通入氮气5min,排除空气后,将烧杯中液体加热至沸腾并保持微沸10min,使粉煤灰中的CaSO3全部分解为SO2并从漏斗尾部溢出,将溶液过滤,此时滤液中SO42-主要由CaSO4电离形成,将滤液加水至约200mL,加热至微沸后加入10mL100g/L的氯化钡溶液,生成BaSO4沉淀,化学反应方程式为:SO42-+Ba2+= BaSO4↓,静置过夜后,过滤并灰化灼烧沉淀物至恒重,称量得到BaSO4质量,并根据公式3计算得到S的质量百分数XS1。
第二步,再称量一定质量的粉煤灰至300mL的烧杯中,加入少量水使其分散后,加入过量的氧化物并加热保持微沸10min,将SO32-全部氧化成SO42-,将溶液过滤,此时中SO42-主要由两部分构成,一是CaSO4电离,二是SO32-被氧化成SO42-,将滤液加水至约200mL,加热至微沸后加入10mL100g/L的氯化钡溶液,生成BaSO4沉淀,静置过夜后,过滤并灰化灼烧沉淀物至恒重,称量得到BaSO4质量,并根据公式1计算得到S的质量百分数XS2。
根据以上两步试验结果,将(XS2- XS1)所得即为SO32-被氧化成SO42-中S的质量百分数,依据公式2,计算得出半水亚硫酸钙质量分数。
![]() 公式1 ;
公式1 ;![]() 公式2
公式2
试验挑选盐酸、氢氟酸、醋酸、抗坏血酸、苯甲酸、单宁酸共计6种常见非氧化性酸,过氧化氢、硝酸、高氯酸、磷酸、高锰酸钾共计5种常见氧化物。并设计了加标法测试S含量试验,技术路线如图1、图2所示。
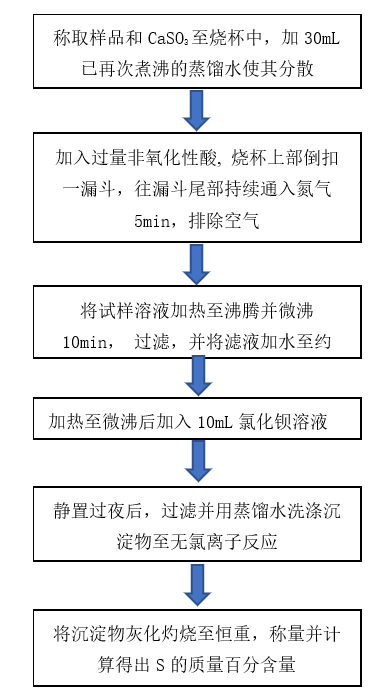
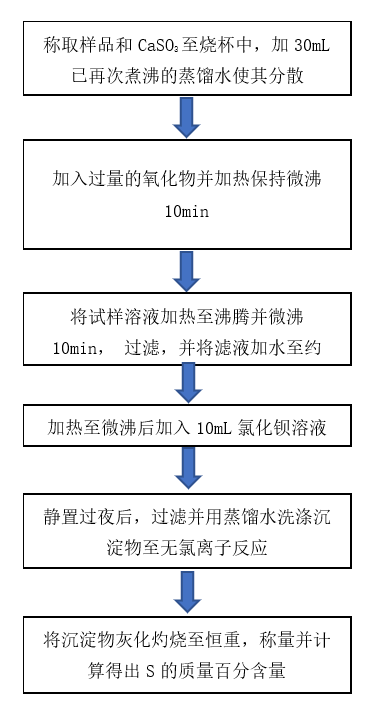
图1最佳非氧化性酸技术路线图 图2最佳氧化物技术路线图
试验过程按照第1.2.2节中确定的最佳非氧化性酸和氧化物种类,考虑到不同浓度检测批次之间在整个测试过程中偏差可能存在不一致问题,同时根据《用于水泥和混凝土中的粉煤灰》GB/T 1596-2017中采用干法或半干法脱硫工艺排除的粉煤灰半水亚硫酸钙含量≤3.0%技术要求,分别对低、中、高不同浓度的三个粉煤灰样品重复7次分析测试,计算测试结果的平均值、标准偏差、相对标准偏差,考察其精密度。同时对空白样品进行加标分析测试,计算测试结果的加标回收率,考察其准确度。
依据图1技术路线图,进行1组空白试验和6组分别加入盐酸、氢氟酸、醋酸、抗坏血酸、苯甲酸、单宁酸的试验,试验结果如表1所示。
表1 最佳非氧化性酸试验结果
类别 序号 | 1# | 2# | 3# | 4# | 5# | 6# | 7# | |
非氧化性酸 | —— | 盐酸 | 氢氟酸 | 醋酸 | 抗坏血酸 | 苯甲酸 | 单宁酸 | |
S,% | 理论 | 0.457 | 0.524 | 0.518 | 0.571 | 0.468 | 0.466 | 0.474 |
测试 | 0.391 | 0.022 | 1.209 | 0.075 | 0.125 | 0.225 | —— | |
SO32-分解率,% | 14.44 | 95.80 | -133.40 | 86.87 | 73.29 | 51.72 | —— | |
试验结果表明:
1#试验中S含量检测结果实际值与理论值较为接近SO32-分解率仅为14.44%,这是由于在没有酸作为介质条件下,Na2SO3加热过程中分解效率低,过滤后Na2SO3以SO32-形式大量留存于滤液中,加入氯化钡溶液后,生成BaSO3,并进一步被氧化为BaSO4,反应方程式为:SO32-+Ba2+= BaSO3↓、2BaSO3+O2=2BaSO4↓。
2#试验中S含量检测结果实际值与理论值相差最大,SO32-分解率最高,为95.80%,这是由于在强酸条件下,SO32-较不稳定,受热分解生成SO2气体脱离反应体系。
3#试验中S含量检测结果实际值远大于理论值,SO32-分解率为负值,分析原因可能是由于氢氟酸除了与Na2SO3反应分解生成SO2气体外,还能够与粉煤灰中的硅反应生成SiF4,在这过程中SiF4以气体的形态离开反应体系,但同时还有大量的SiF4进一步水解生成硅酸,反应方程式为:3SiF4+3H2O=H2SiO3+2H2SiF6,并进一步与氯化钡反应生成沉淀,最终导致硫检测结果产生偏差。
4#试验中S含量检测结果实际值与理论值相差较大,SO32-分解率为86.87%,醋酸为弱酸,在水溶液中能够电离出H+,并进一步在加热条件下使SO32-分解生成SO2气体,化学方程式为:CH3COOH⇌CH3COO+H+、2H++SO32-= H2O+SO2↑。
5#试验中S含量检测结果实际值与理论值相差较大,SO32-分解率为73.29%,抗坏血酸是一种多羟基化合物,化学式为C6H8O6,结构类似葡萄糖,呈弱酸性,其分子中第2及第3位上两个相邻的烯醇式羟基极易解离而释出H+,并进一步在加热条件下使SO32-分解生成SO2气体。
6#试验中S含量检测结果实际值与理论值相差大,SO32-分解率为51.72%,苯甲酸微溶于水,电离常数Ka=6.4×10-5(25℃),在水中部分电离成苯甲酸根离子和氢离子,电离方程式为:C6H5COOH⇌C6H5COO-+H+,因此溶液中H+浓度较低,限制了其与SO32-反应速率。
7#试验过程中,加入单宁酸后,溶液呈粘稠状,无法过滤,导致试验无法继续进行,分析原因可能是由于单宁酸具有强吸湿性,易絮凝,与粉煤灰结合后形成不溶于水的混合物,导致整个反应体系呈现粘稠状,试验无法继续进行。
综上所述,氢氟酸、单宁酸不适合用来作为本试验的反应用酸,盐酸、醋酸、抗坏血酸、苯甲酸对SO32-分解具有积极的作用,其中以2#试验加入盐酸后,SO32-分解率最高,因此选定盐酸为最佳非氧化性酸。
依据图2技术路线图,进行5组分别加入过氧化氢、硝酸、高氯酸、磷酸、高锰酸钾的试验,试验结果如表2所示。
表2 最佳氧化性剂试验结果
序号 类别 | 1# | 2# | 3# | 4# | 5# | |
氧化剂 | 过氧化氢 | 硝酸 | 高氯酸 | 磷酸 | 高锰酸钾 | |
S,% | 理论 | 0.470 | 0.542 | 0.547 | 0.531 | 0.478 |
测试 | 0.469 | 0.394 | 0.039 | 0.025 | 0.455 | |
SO32-被氧化率,% | 99.79 | 72.69 | 7.13 | 4.71 | 95.19 | |
试验结果表明:
1#试验中S含量检测结果实际值与理论值非常接近,SO32-氧化率达99.79%,过氧化氢具有较强的氧化性,能够将SO32-全部转化为SO42-,且其副产物为H2O,过量的过氧化氢加热易分解生成O2和H2O,所涉及的主要化学反应方程式为:SO32-+H2O2=SO42-+H2O、H2O2=H2O+O2↑,整个试验过程不会引入新杂质。
2#试验中S含量检测结果实际值低于理论值,SO32-氧化率为72.69%,硝酸是一种具有强氧化性、腐蚀性的一元无机强酸,稀硝酸与SO32-主要反应生成的副产物主要为NO↑和H2O。
3#试验中S含量检测结果实际值低于理论值,SO32-氧化率为7.13%,高氯酸又名过氯酸,化学式为HClO4,是目前已知的酸性最强的无机酸,高氯酸在高浓度情况下具有强氧化性,在低浓度时主要表现为氢离子的氧化性,即酸性。
4#试验中S含量检测结果实际值只有理论值的二十分之一,SO32-氧化率仅为4.71%,氧化性较弱。
5#试验中高锰酸钾是一种强氧化剂,易溶于水,中性条件反应过程为2MnO4-+H2O+3SO32-=MnO2↓+3SO42-+2OH-;通过试验测试得出,S含量检测结果实际值与理论值较接近,SO32-氧化率为95.19%。
综上所述,高氯酸、磷酸不适合用来作为本试验的氧化剂,过氧化氢、硝酸、高锰酸钾氧化SO32-有积极的作用,其中以1#试验加入过氧化氢后,SO32-被氧化率最高,且不会引入新杂质,因此过氧化氢为最佳氧化剂。
实验精密度结果见表4,准确度结果见表5。
表4 精密度试验
序号 | 低浓度 | 中浓度 | 高浓度 |
半水亚硫酸钙含量,% | 半水亚硫酸钙含量,% | 半水亚硫酸钙含量,% | |
1 | 0.84 | 1.67 | 3.01 |
2 | 0.72 | 1.57 | 3.00 |
3 | 0.82 | 1.64 | 2.98 |
4 | 0.82 | 1.64 | 2.95 |
5 | 0.73 | 1.63 | 3.00 |
6 | 0.71 | 1.59 | 3.09 |
7 | 0.76 | 1.61 | 2.97 |
平均值 | 0.77 | 1.62 | 3.00 |
标准偏差 | 0.05 | 0.03 | 0.04 |
相对标准偏差 | 6.52 | 1.93 | 1.38 |
重复性限,% | 0.13 | 0.10 | 0.14 |
表5准确度试验
低浓度 | 中浓度 | 高浓度 | ||||||
加标量,% | 测试含量,% | 加标回收率,% | 加标量,% | 测试含量,% | 加标回收率,% | 加标量,% | 测试含量,% | 加标回收率,% |
0.77 | 0.84 | 109 | 1.78 | 1.86 | 104 | 3.05 | 3.30 | 108 |
0.77 | 0.90 | 117 | 1.74 | 1.68 | 97 | 3.07 | 3.26 | 106 |
0.75 | 0.71 | 95 | 1.72 | 1.64 | 95 | 3.03 | 2.97 | 98 |
0.77 | 0.70 | 91 | 1.78 | 1.71 | 96 | 3.07 | 2.86 | 93 |
0.75 | 0.63 | 84 | 1.90 | 1.95 | 103 | 3.05 | 3.20 | 105 |
0.80 | 0.91 | 114 | 1.80 | 1.87 | 104 | 3.06 | 2.79 | 91 |
0.75 | 0.66 | 88 | 1.68 | 1.63 | 97 | 3.07 | 3.26 | 106 |
依据《合格评定 化学分析方法确认和验证指南》GB/T 27417-2017[5]对方法的一般要求,当被测物含量≤1%时,相对标准偏差≤2.7%;被测物含量>1%且≤10%时,相对标准偏差≤2.0%;被测物含量>0.01%时,回收率为(95-105)%,同时参照GB/T 5484-2012《石膏化学分析方法》重复性限≤0.15%的要求。该研究方法对低、中、高三组不同浓度样品进行7次重复试验,考察本研究方法的精密度,结果显示:低浓度样品相对标准偏差6.52%,重复性限0.13%;中浓度样品相对标准偏差1.93%,重复性限0.10%;高浓度样品相对标准偏差1.38%,重复性限0.14%,低浓度精密度无法满足标准要求。该研究方法对低、中、高三组不同浓度样品进行7次加标回收率试验,考察方法的准确度,结果显示:低浓度样品加标回收率范围在85%~116%之间,无法满足标准要求;中浓度样品加标回收率范围在95%~104%之间,符合标准要求;高浓度样品加标回收率范围在93%~108%之间,无法满足标准要求。
采用干法或半干法脱硫工艺排出的粉煤灰,其硫元素主要以CaSO4(化合物中S为+6价)和CaSO3(化合物中S为+4价)形式存在,其中SO42-很稳定,SO32-较不稳定,酸性条件下受热易分解,同时SO32-具有还原性,能够被强氧化剂氧化生成稳定的SO42-,该研究方法即是依据该特性,首先加入非氧化性酸,并加热使SO32-分解生成SO2↑,测试S(+6价)含量;与此同时取另一样品加入氧化剂,将SO32-全部氧化生成SO42-,测试S(+6价和+4价)的总含量;由此可计算出S(+4价)含量,并进一步计算得出半水亚硫酸钙含量。
通过以上分析试验可知,盐酸体系环境下,SO32-加热分解率最高;过氧化氢能够高效的将SO32-氧化,且不会引入新的杂质。该研究方法对中等含量(1.6%左右)半水亚硫酸钙具有较好的精密度和准确度,较低含量(0.7%左右)和高含量(3.0%左右)半水亚硫酸钙精密度和准确度虽不能达到要求,但是偏差相对较小,可以通过优化酸和氧化物的用量、采用混合酸或混合氧化物、优化反应时间和加热温度等手段降低偏差,由于项目时间关系,该研究方法已验证原理的可行性,方法的优化待日后进一步试验验证。该研究方法试验步骤易于操作,所使用化学药品毒性和危险性较低,对环境的污染小也较小,因此具有良好的研究和应用前景。
参考文献
GB/T 1596-2017用于水泥和混凝土中的粉煤灰[S].中国标准出版社.2017.
GB/T5484-2012石膏化学分析方法[S].中国标准出版社.2013.
顾文飞,唐欧靖,康明,周维.干法脱硫粉煤灰物化性能及用于建材的安全性研究[J].宝钢技术,2012,(2):31-35.
王文龙,崔琳,马春元,董勇,徐夕仁. 干法脱硫灰的理化特性及其综合利用现状[J].电站系统工程.2005.21(5):27-29.
GB/T 27417-2017合格评定 化学分析方法确认和验证指南[S].中国标准出版社.2017.