1眉山天府新区实验中学 四川 眉山 620564;2西昌学院21级动科1班 四川 西昌 615013
摘要:探析22年高考甲卷27题实验大题,逐一分析三个争议问题的原因,以及各种答案的出现及其合理性分析,再结合相应实验的文献出处,深层次揭秘本次实验的原理、步骤,分析争议原因。
关键词:高考实验题;优质硫化钠;过滤;结晶提纯;乙醇回流
一、试题再现:2022年全国甲卷理科综合卷27题实验题部分如下
硫化钠可广泛用于染料、医药行业。工业生产的硫化钠粗品中常含有一定量 的煤灰及重金属硫化物等杂质。硫化钠易溶于热乙醇,重金属硫化物难溶于乙醇。实验室中常用95%乙醇重结晶纯化硫化钠粗品。回答下列问题:
1.工业上常用芒硝(Na2 SO4 •10H2O)和煤粉在高温下生产硫化钠,同时生成CO,该反应的化学方程式为_______。
2.溶解回流装置如图1所示,回流前无需加入沸石,其原因是_______。
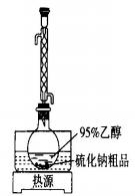
图 1
3.回流时间不宜过长,原因是_______。
4.该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是_______。其中蒸馏不加沸石,过滤用锥形瓶而不能用烧杯接收滤液是突破常规的问法。
二、有争议的填空有哪些不同的答案
第2问回流前无需加入沸石,从学生答题角度看问题不大,既然加热煮沸均需加沸石那现在不加肯定有什么东西充当沸石,从题目说明来看只能是煤灰及重金属杂质充当沸石。其他观点认为加热之前均应该加沸石,不加则是不规范操作,况且不是什么东西都可以充当沸石,有没有孔隙及孔隙是否堵塞均是考虑因素。不宜摸拟试题曾出现过这样的代替沸石而加以推广。
第3问回流时间不宜过长,这一空来看一下有哪些回答(本文所有回答均精选来自一线的教师QQ群或部分书店中高考真题卷的答案)。答案一长时间回流,乙醇带出Na2S在球形冷凝管中聚集;答案二长时间回流消耗大量乙醇从而析出Na2S而造成损失,因为后续过滤操作以滤渣形式除去,此观点重在乙醇挥发产品结晶析出与第一种析出不一样;答案三减少溶剂挥发,避免多次回流时带入过多空气从而将Na2S氧化此观点重在氧化。笔者认为高中阶段蒸发或蒸馏虽然能带出少量溶质但一般不考虑可以忽略不计,所以答案一回答肯定不靠谱。另二种说法均有一定的道理,硫化钠易氧化和水解学生有很深的认识。
第4问该实验过滤操作时,用锥形瓶而不能用烧杯接收滤液其原因。这空学生上课平时老师都是强调用烧杯来接,而现在不能用烧杯用锥形瓶接还要说出理由真的有点想不到原因。原因又只能从烧杯与锥形瓶的形状差异来说,比如一个是竖直开口更大、液体易挥发,一个是收口开口更小、方便手捏住不下落比如滴定试验等。答案一防止滤液冷却(言下之意锥形瓶有保温聚气的作用);答案二锥形瓶比烧杯口子小可以减少乙醇挥发同时减少热量散失,防止硫化钠晶体析出(只是语言上更明确而已防析出);答案三烧杯口径大热量散失快易造成硫化钠析出,且硫化钠易被空气中氧气氧化乙醇易挥发,所以选择口径小的锥形瓶(相当于多了一点防止氧化);答案四防止液体沿烧杯内壁流下过程中与空气接触使硫化钠被氧化。(这个是联想到了烧杯与锥形瓶具体形状差异而想象到了液体下落中的情形不同、重在强调防止氧化)而前面三个答案均强调保温作用或挥发二者是有联系的。但笔者认为锥形瓶虽然可以减少挥发从而达到保温聚气的作用,但是没必要保滤液的温。下一步降温冷却结晶,口子小减少挥发、因为乙醇是易燃物按照实验安全操作规则采用小口径仪器锥形瓶盛装。或者答案四所述锥形瓶来接必然是悬空方式,烧杯来接必然是接触式流下(否则会四处飞溅)再根据这种流下方式不同接触氧气的程度不同从氧化角度来答题。
三、查阅试题相应文献[1],下面是部分内容摘取
2
1.试剂极含乙醇95%三级(化学纯)试剂提纯工业硫化钠时装置和部分说明(装置见图2)

图2
本实验所用的硫化钠是山西省运城盐化局盐化二厂生产的含Na2S63%、H2O35%左右其余为杂质的片状工业硫化钠,乙醇为北京化工厂生产的含乙醇95%的三级(化学纯)试剂。称取片状工业硫化钠140克,三口烧瓶(2000mL)中间的大口装800mm(管径)的球形冷凝管,左边小口装温度计,右边小口装添加乙醇及水的分液漏斗,从漏斗中加入95%的试剂乙醇1000mL,加入NaOH2克、加水,在水浴上回流1.5小时,待乙钠溶液(乙醇和氢氧化钠)被硫化钠饱和以后,保温沉降5分钟,吸滤(抽滤)、冷却,待滤液结晶后再吸滤,用200mL乙钠分三次洗涤滤饼,吸干滤饼称重即可得到无色结晶产品(Na2S•xH2Ox=5~6)。母液可循环使用三次后用蒸馏法回收乙醇和硫化钠。
2.工业酒精(95%的工业酒精价格便宜)沥取工业硫化钠法时的装置和部分说明装置如图3

图 3
3
在非水溶剂沥取法制取优质硫化钠中,使用了试剂乙醇为溶剂,由于试剂
乙醇的价格较高,因此就想到是否可以用工业酒精代替试剂乙醇的问题。据此,进行了用工业酒精代替试剂乙醇沥取工业硫化钠的试验。方法步骤与第一种相同所得产品经分析同样得到了无色优质硫化钠(Na2S•xH2O)。
3.工业酒精沥取“黑灰”法,采用“黑灰”代替工业硫化钠
同样的方法步骤也可以制得无色优质硫化钠。这里的黑灰即为高考中出现的工业生产硫化钠粗品第一步反应的产物。文献中介绍的这三种结晶纯化硫化钠方法,步步深入改变试剂或原料,但实验操作方法步骤和最终的效果是一致的。
四、结合高考对该实验深层次解读
实验目的要制得符合化学试剂规格的优质硫化钠,传统方法是用氰化钠对工业硫化钠加工精制,缺点氰化钠是剧毒剂。而在碱性水溶液中,标准电极电势[2]S→S2-为-0.48伏,O2→OH-标准电极电势为+0.401伏。因而在标准态下空气中的氧可以将溶液中的S2-离子氧化为S,后者进一步与前者反应生成多硫化合物Na2Sx(x=2—6),因多硫化合物(溶于乙醇)的存在将影响产品的颜色,加入1%—2%的NaOH时产物的颜色可大为改善甚至消除这可能是在OH-离子存在下多硫离子产生歧化反应的缘故。根据硫化钠可溶于极性较大的非水溶剂中且极性越大溶解度越大,已知极性大小:水>甲醇>乙醇,硫化钠在三者中溶解度大小同样如此,但是S2-和铁制设备反应的产物也是影响硫化钠产品质量的原因,加上氧气氧化由此想在水溶液中制取优质硫化钠很困难。甲醇同样有毒,所以极性较大的低级醇类乙醇便成了首选。同时考虑到在乙醇溶剂中,S→S2-和O2→OH-的电极电势肯定不同于在水溶液中。实验表明该方法可制得优质硫化钠,高等学校试用教材《无机化学试验》一书已采用为实验[3]。
五、试题与文献比较结合中学教学实际思考出题者考查方向
高考试题基本上采用了文献中图3中的装置图和第三种所述原材料,结合我国国情是用煤粉还原芒硝法生产工业用硫化钠,所得第一步产物称之为“黑灰”,含硫化钠约75%,水约5%,其余为杂质渣约为20%均不溶于乙醇(可能有Na2SO4、Na2S2O3、Na2CO3、铁的化合物和炭等有了这些明确信息不加沸石才能让人理解),通过乙醇长达1.5个小时的回流制成乙醇的硫化钠饱和溶液。同时回流也可以大大的节约乙醇用量,将此溶液趁热过滤(应该采用吸滤即抽滤),滤液自然或强制冷却硫化钠即可结晶析出,再过滤、洗涤(95%的冷乙醇洗或者用母液洗)即可获得优质产品。只不过实际生产中母液尚需循环使用三次后再用蒸馏法回收乙醇和硫化钠,这里没有提及。总体来说所考查内容也谈不上最新最前沿知识,反而是近代(几十年前)就有的工业生产知识,内容恰好也是学生最熟悉的结晶提 纯但问题的问法让考生措手不及。实际上的实验过程也是回流时间最长而其它操作耗时均几分钟左右,笔者认为这三个问的问法确实有待商榷。为什么要回流且长时间充分回流,为什么要用乙醇做溶剂,乙醇做溶剂与水做溶剂时的区别,注意防火且还要回收乙醇,硫化钠易水解易被氧化、趁热过滤最好采用抽滤及母液的循环使用等等才是核心要点或考查点。
六、对高考试题的再认识既教师教学的反思
高考已结束,今年高考全国甲卷理科综合卷也不再公布官方答案,毫无疑问今年甲卷实验大题分值最高、考生失分也最严重,在选拔性考试面前高分意为着成功。但是这个传统意义上的纯化重结晶试验,让考生有点抓狂相信答案也不一刀切合理即可。做为教师教学应该意识到光机械式的大量练题固然可以培养出解题机器人、速度超快,但是可能忽略了学科核心思想、核心本质其负面影响可能是致命的。这里考查操作没有标准答案只有最佳答案、越来越强调化学来源于生产生活,更要服务于生产生活。因为大量练题,思维固化变得僵硬单一、往往固执于一端生搬硬套。降低了解题的准确度成了高耗低效复习,遇到本实验题这样实际操作突破常规的问法可能难读懂并解好题。
参考文献:
[1]顾宏邦.非水溶剂沥取法制取优质硫化钠[J].山西大学学报(自然科学版),1980(3):43-54.
[2]严宣申.化学原理选讲[M].北京:北京大学出版社,2012.8:253-254.
[3]中山大学、辽宁大学等校编.无机化学实验[M].人民教育出版社,1978.
4
5